Trametinib
Handelsnamen: Mekinist®, Spexotras®
Synonyme: GSK-1120212, JTP-74057, Trametinibum
Englisch: trametinib
Definition
Trametinib ist ein antineoplastisch wirkender Arzneistoff, der zur Gruppe der MEK-Inhibitoren gehört und zur Behandlung von Gliomen, Melanomen und nicht-kleinzelligen Bronchialkarzinomen eingesetzt wird.
Chemie
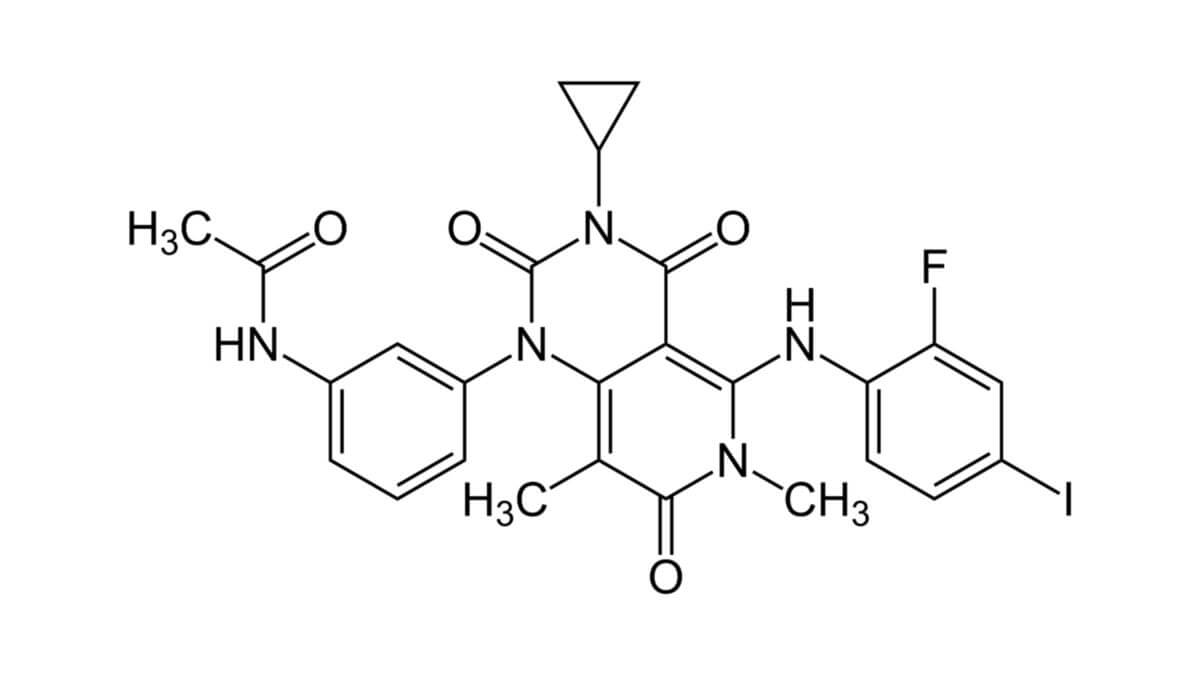
Trametinib ist ein Pyridin- und ein Pyrimidin-Derivat. Die Synthese verläuft mehrstufig aus den Edukten Cyclopropylamin und einem Isocyanatderivat. Die Summenformel ist C26H23FIN5O4. Der chemische Name ist
- N-[3-[3-Cyclopropyl-5-(2-fluoro-4-iodoanilino)-6,8-dimethyl-2,4,7-trioxopyrido[4,3-d]pyrimidin-1-yl]phenyl]acetamid (IUPAC)
Die molare Masse beträgt 615,40 g/mol, der Oktanol-Wasser-Koeffizient (logP) 3,45. Die CAS-Nummer lautet 871700-17-3. Als Arzneistoff wird Trametinib-Dimethylsulfoxid (CAS-Nummer 1187431-43-1; molare Masse 693,53 g/mol) eingesetzt, das bei Raumtemperatur als weißes Pulver vorliegt und in Wasser praktisch unlöslich ist.
Wirkmechanismus
Trametinib greift in den MAP-Kinase-Signalweg ein, der an der Steuerung des Zellwachstums beteiligt ist. Eine Fehlregulation dieses Signalwegs kann durch mehrere Ursachen entstehen, einschließlich einer Mutation im BRAF-Gen. Diese Veränderung wird mit vielen verschiedenen Tumorarten in Verbindung gebracht.
Die häufige BRAF-V600-Mutation führt zu einer überaktiven nachgeschalteten Signalübertragung durch MAP-Kinasen. Sie phosphorylieren die Proteinkinase ERK, was zur Aktivierung verschiedener Transkriptionsfaktoren führt. Dadurch kommt es zur Expression von Genen, welche die Proliferation der Tumorzellen regulieren und ihr Überleben ermöglichen.
Trametinib bindet reversibel und selektiv an die Mitogen-akivierten Proteinkinasen MEK-1 und MEK-2 und führt zu einer allosterischen Hemmung dieser Enzyme. Bei einer Vielzahl von Zielgenen wird so die Transkription unterbrochen und der onkogene Signalweg blockiert.[1]
Pharmakokinetik
Trametinib wird nach oraler Aufnahme rasch und vollständig resorbiert. Die Bioverfügbarkeit beträgt 72 %. Maximale Plasmaspiegel werden nach 1,5 Stunden erreicht. Die Plasmaproteinbindung beträgt 97 %, das Verteilungsvolumen ca. 1.200 Liter (ca. 17 l/kgKG). Die Biotransformation erfolgt durch Deacetylierung mittels hydrolytischer Enzyme (z. B. Carboxylesterasen) und/oder Oxygenierung. Der Metabolismus über das Cytochrom-P450-Isoenzym CYP3A4 ist von untergeordneter Bedeutung. Die Metaboliten werden glucuronidiert. Die Elimination erfolgt überwiegend mit den Fäzes. Die Eliminationshalbwertszeit beträgt 127 Stunden.[1]
Indikationen
Voraussetzung für die Anwendung von Trametinib ist der Nachweis einer BRAF-V600-Mutation durch Sequenzierung des Tumorgenoms.
Als Monotherapie oder in Kombination mit Dabrafenib wird Trametinib in folgenden Indikationen eingesetzt:
- nicht-resezierbares oder metastasiertes Melanom mit einer BRAF-V600-Mutation und adjuvante Melanom-Behandlung nach vollständiger Resektion (erwachsene Patienten)
In Kombination mit Dabrafenib wird Trametinib bei folgenden Indikationen eingesetzt:
- fortgeschrittenes nicht-kleinzelliges Bronchialkarzinom mit einer BRAF-V600-Mutation (erwachsene Patienten)[1]
- niedriggradiges malignes Gliom (low-grade glioma, LGG) mit einer BRAF-V600E-Mutation (pädiatrische Patienten ab einem Alter von 1 Jahr, die eine systemische Therapie benötigen)
- hochgradiges malignes Gliom (high-grade glioma, HGG) mit einer BRAF-V600E-Mutation (pädiatrische Patienten ab einem Alter von 1 Jahr, die zuvor mindestens eine Strahlen- und/oder Chemotherapie erhalten haben)[2]
Darreichungsform
Trametinib steht in Form von Filmtabletten und als Pulver zur Herstellung von Lösungen zur oralen Anwendung zur Verfügung.
Dosierung
Als Filmtablette wird eine Dosis von 2 mg einmal täglich (als Monotherapie oder in Kombination mit Dabrafenib 150 mg zweimal täglich) empfohlen.[1]
Die Dosis der zu verabreichenden Lösung richtet sich nach dem Körpergewicht der Patienten (Tabelle in der Fachinformation).[2]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Die häufigsten unerwünschten Wirkungen von Trametinib sind:[1][2]
- Kopfschmerzen, Fatigue, Pyrexie (≥ 38 °C), Asthenie, Ödeme
- Haut: Juckreiz, Trockene Haut, Dermatitis Haarausfall, Exanthem, Hand-Fuß-Syndrom, Erythem
- Auge: Uveitis, Retinopathie (Verschluss der Netzhautvenen, Ablösung des Netzhautpigmentepithels)
- Gastrointestinaltrakt: Nausea, Erbrechen, Diarrhö, Obstipation, Xerostomie, Stomatitis
- Atemwege: Husten, Atemnot, Pneumonitis, Interstitielle Pneumonie
- Infektionen: Follikulitis, Paronychie, Zellulitis
- Stoffwechsel: Dehydratation
- Gefäßsystem: Hypertonie, Hämorrhagie, Lymphödem
- Störungen der Leber- und Nierenfunktion
- hämophagozytische Lymphohistiozytose (HLH)
Unter der Behandlung kann es zu malignen Neuerkrankungen kommen. Es können schwere, tödlich verlaufende hämorrhagische Diathesen auftreten. Über akute, schwere linksventrikuläre Dysfunktion infolge einer Myokarditis wurde berichtet.
Wechselwirkungen
Metabolische verursachte Interaktionen sind bisher (2024) nicht bekannt. Theoretisch könnten erhöhte Trametinibspiegel bei einer starken Hemmung von P-Glykoprotein (P-gp) auftreten.
Das Blutungsrisiko ist bei gleichzeitiger Einnahme gerinnungshemmender Wirkstoffe erhöht
Kontraindikationen
- Überempfindlichkeit gegen Trametinib oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft und Stillzeit
Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt. Patientinnen im gebärfähigen Alter sind anzuweisen, wirksame Verhütungsmethoden während der Behandlung mit Trametinib und bis zu 16 Wochen nach Behandlungsende anzuwenden. Dabei ist zu beachten, dass Trametinib die Wirksamkeit hormoneller Kontrazeptiva verringert. Bei einer bestehenden Schwangerschaft sollte Trametinib nicht angewendet werden.[1]
Es ist nicht bekannt, ob Trametinib in die Muttermilch übertritt. Ob das Stillen zu unterbrechen ist oder auf die Behandlung während der Stillzeit verzichtet werden soll, ist im Einzelfall zu entscheiden.[1]
Toxizität
Es liegen aktuell (2024) keine Erfahrungen zur Symptomatik einer Überdosierung oder Vergiftung mit Trametinib vor. Es ist davon auszugehen, dass die bekannten Nebenwirkungen in verstärktem Maße auftreten. Eine primäre Giftentfernung durch Verabreichung von Aktivkohle kann innerhalb einer Stunde nach der Ingestion erfolgen. Die weitere Behandlung erfolgt in jedem Fall symptomatisch. Ein spezifisches Antidot steht bisher (2024) nicht zur Verfügung. Aufgrund seiner pharmakokinetischen Eigenschaften (hohe Plasmaproteinbindung; großes Verteilungsvolumen) ist eine sekundäre Giftentfernung durch Hämodialyse nicht effektiv.
Nutzenbewertung
Ein Zusatznutzen einer Therapie mit Trametinib wird vom G-BA auf der Basis der vom IQWiG ausgewerteten Studienergebnisse wie folgt eingeordnet:[5]
- nicht belegter Zusatznutzen der Monotherapie gegenüber einer zweckmäßigen Vergleichstherapie mit Vemurafenib
- Hinweis auf einen beträchtlichen Zusatznutzen der Kombinationstherapie mit Trametinib und Dabrafenib gegenüber einer zweckmäßigen Vergleichstherapie mit Vemurafenib bei Frauen
Kosten
Die Jahrestherapiekosten einer Monotherapie mit Trametinib betragen rund 100.000 €.[5]
ATC-Code
- L01EE01 - Antineoplastische Mittel - Proteinkinase-Inhibitoren - Mitogen-akivierte Proteinkinase (MEK)-Inhibitoren
Quellen
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Zusammenfassung der Merkmale des Arzneimittels Mekinist, EMA, abgerufen am 21.02.2024
- ↑ 2,0 2,1 2,2 Zusammenfassung der Merkmale des Arzneimittels Spexotras, EMA, abgerufen am 21.02.2024
- ↑ Mekinist. EMA, abgerufen am 21.02.2024
- ↑ Spexotras. EMA, abgerufen am 22.05.2024
- ↑ 5,0 5,1 IQWIg-Berichte-Nr.354 Trametinib Nutzenbewertung gemäß § 35a SGB V abgerufen am 05.12.2018
Weblinks
- Drugbank - Trametinib, abgerufen am 21.02.2024
- Pharmazeutische Zeitung Arzneistoffe - Trametinib, abgerufen am 21.02.2024
- Gelbe Liste Wirkstoffe - Trametinib, abgerufen am 21.02.2024
- PharmaWiki - Trametinib, abgerufen am 21.02.2024
- PubChem: 11707110
- MeSH: 67560077