Dabrafenib: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
||
| (11 dazwischenliegende Versionen von 3 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
'' | ''Handelsnamen: Finlee<sup>®</sup>, Tafinlar<sup>®</sup>'' <br> | ||
''Synonym: GSK-2118436'' <br> | |||
'''''Englisch''': <name lang="en">dabrafenib</name>'' | |||
==Definition== | ==Definition== | ||
'''Dabrafenib''' ist ein [[ | '''Dabrafenib''' ist ein [[Antineoplastisch|antineoplastischer]] [[Arzneistoff]] aus der [[Wirkstoffklasse|Klasse]] der [[Proteinkinaseinhibitor|Proteinkinase-Inhibitor]]en. Es handelt sich um einen [[BRAF-Kinase-Inhibitor]], der als Monotherapie oder in Kombination mit [[Trametinib]] zur Behandlung des [[Malignes Melanom|malignen Melanoms]], des [[Nicht-kleinzelliges Lungenkarzinom|nicht-kleinzelligen Bronchialkarzinoms]] (NSCLC) und des [[Gliom|Glioms]] eingesetzt wird, wenn eine [[BRAF-V600E-Mutation]] der Tumorzellen nachgewiesen wurde. | ||
==Chemie== | ==Chemie== | ||
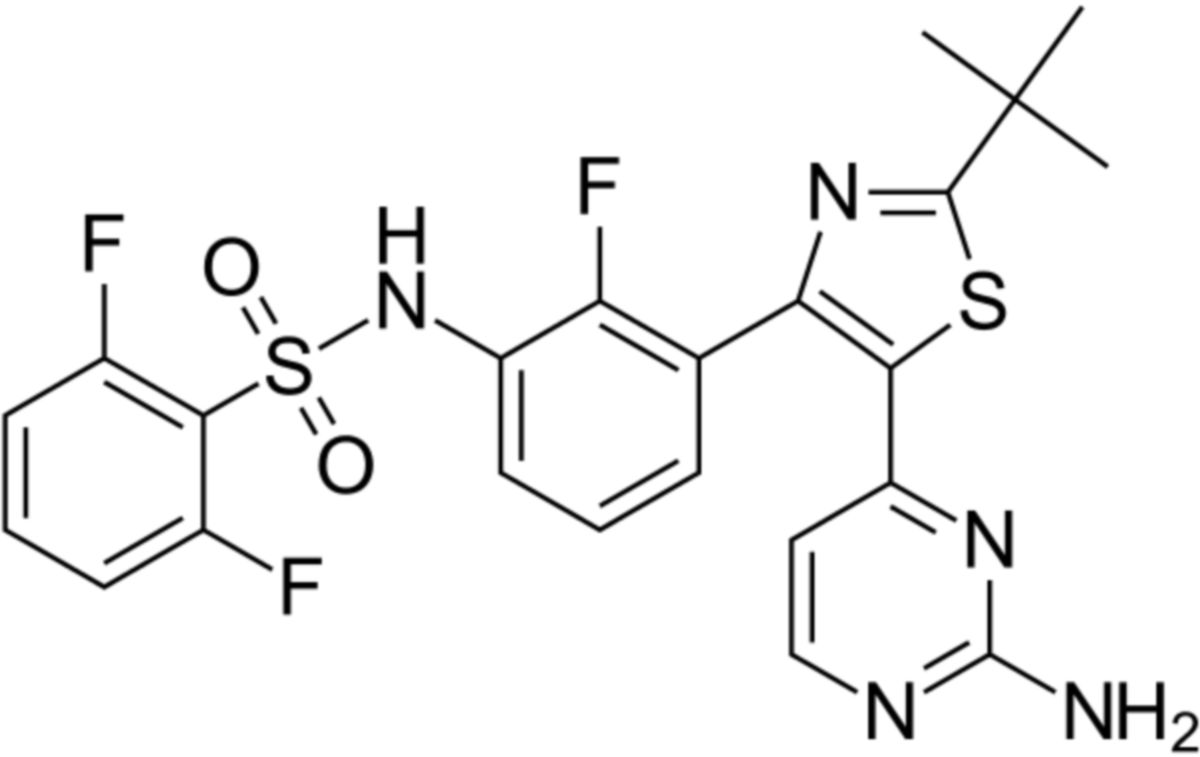
Die Summenformel | Dabrafenib ist ein [[Pyrimidin]]- und ein [[Thiazol]]--Derivat. Der Wirkstoff wird über mehrere Zwischenstufen aus 3-Brom-2-fluorbenzoesäure, [[Methanol]] und anderen organischen Verbindungen synthetisiert. Die [[Summenformel]] ist C<sub>23</sub>H<sub>20</sub>F<sub>3</sub>N<sub>5</sub>O<sub>2</sub>S<sub>2</sub>. Der chemische Name lautet | ||
*N-[3-[5-(2-Aminopyrimidin-4-yl)-2-tert-butyl-1,3-thiazol-4-yl]-2-fluorophenyl]-2,6-difluorbenzensulfonamid ([[IUPAC]]) | |||
Die [[molare Masse]] beträgt 519,6g/[[mol]], der [[Oktanol-Wasser-Koeffizient]] (logP) 5,44. Die [[CAS-Nummer]] ist 1195765-45-7. Als [[Arzneistoff]] wird Dabrafenibmesilat verwendet, ein [[Salz]] der [[Methylsulfonsäure]] (MSS), ein weißes bis leicht gefärbtes Pulver, das in Wasser praktisch unlöslich ist. | |||
<dcembed><dcembedurlphoto src="https://www.doccheck.com/de/detail/photos/38964-dabrafenib-svg" showtitle="yes" align="center" size="s"></dcembedurlphoto></dcembed> | <dcembed><dcembedurlphoto src="https://www.doccheck.com/de/detail/photos/38964-dabrafenib-svg" showtitle="yes" title="Dabrafenib" align="center" size="s"></dcembedurlphoto></dcembed> | ||
==Wirkmechanismus== | ==Wirkmechanismus== | ||
Dabrafenib bindet [[selektiv]] an die [[Serin | Dabrafenib bindet [[selektiv]] an die [[Serin-Threonin-Kinase]] BRAF und blockiert dadurch die Aktivierung des [[Ras/Raf/MAPK-Signalweg|RAS/ RAF/MEK/ERK-Signalweg]]s, der an der Steuerung des [[Zellwachstum]]s beteiligt ist. [[Onkogen|Onkogene]] Mutationen im [[BRAF]]-Gen können eine Überaktivität des [[Signalweg]]s hervorrufen, was zu unkontrolliertem Zellwachstum und damit zu [[Krebs]] führen kann. Dadurch werden von diesem Signalweg abhängige [[Transkriptionsfaktor]]en nicht mehr [[Phosphorylierung|phosphoryliert]] und es kommt bei einer Vielzahl von Zielgenen zum Abbruch der [[Transkription]], sodass die [[Proliferation]] der Tumorzellen blockiert und das Wachstum des Tumors gestoppt wird.<ref name="fachinfo"> [https://www.fachinfo.de/api/public/fachinfo/pdf/014892 Fachinformation Tafinlar], Novartis Pharma, abgerufen am 02.05.2024</ref><ref name="pz"> Pharmazeutische Zeitung Online [https://www.pharmazeutische-zeitung.de/arzneistoffe/daten/2013/dabrafenibtafinlar174862013/ Arzneistoffe | Dabrafenib] abgerufen am 29.11.18</ref> | ||
Dabrafenib ist gegen die BRAF-Varianten [[V600E]], V600K und V600D wirksam. | Dabrafenib ist gegen die BRAF-Varianten [[V600E]], V600K und V600D wirksam. | ||
==Pharmakokinetik== | ==Pharmakokinetik== | ||
[[Maximale | Dabrafenib wird nach [[Oral|oraler]] Aufnahme rasch resorbiert. [[Maximaler Plasmaspiegel|Maximale Plasmaspiegel]] werden nach 1,5 bis 2 Stunden erreicht. Die [[Bioverfügbarkeit]] erreicht 95 %. Die [[Plasmaproteinbindung]] beträgt 100 %, das [[Verteilungsvolumen]] 46 Liter (ca. 0,7 l/[[kgKG]]). Die [[Biotransformation]] in der Leber erfolgt über die [[Cytochrom P450|Cytochrom-P450]]-[[Isoenzym|Isoenzyme]] [[CYP2C8]] und [[CYP3A4]]. Die Elimination der Metaboliten erfolgt zu 71 % mit den [[Fäzes]] und zu 23 % mit dem [[Urin]]. Die [[Eliminationshalbwertszeit]] beträgt etwa 10 Stunden.<ref name="fachinfo"></ref> | ||
Die [[Eliminationshalbwertszeit]] | |||
==Indikation== | ==Indikation== | ||
* [[Monotherapie]] von erwachsenen Patienten mit | * [[Monotherapie]] von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation<ref name="fachinfo" /> | ||
* [[Kombinationstherapie]] mit | * [[Kombinationstherapie]] mit Trametinib | ||
* | **bei erwachsenen Patienten mit fortgeschrittenem nicht-kleinzelligem Bronchialkarzinom (NSCLC) mit einer BRAF-V600-Mutation<ref name="fachinfo"></ref> | ||
**bei pädiatrischen Patienten ab einem Alter von einem Jahr mit einem niedriggradig malignem Gliom mit einer BRAF-V600E-Mutation, die eine systemische Therapie benötigen<ref name=":0" /> | |||
**bei pädiatrischen Patienten ab einem Alter von einem Jahr mit einem hochgradig malignem Gliom mit einer BRAF-V600E-Mutation, die zuvor mindestens eine Strahlen- und/oder Chemotherapie erhalten haben<ref name=":0">[https://www.ema.europa.eu/de/documents/product-information/finlee-epar-product-information_de.pdf Zusammenfassung der Merkmale des Arzneimittels Finlee], EMA, abgerufen am 02.05.2024</ref> | |||
==Besondere Hinweise== | ==Besondere Hinweise== | ||
Vor der Anwendung von Dabrafenib muss beim Patienten die BRAF-V600E-Mutation mittels eines [[In-vitro-Diagnostikum|In-vitro-Diagnostikums]] (IVD) mit CE-Kennzeichnung mit der entsprechenden Zweckbestimmung bestätigt worden sein. Sollte ein IVD mit CE-Kennzeichnung nicht verfügbar sein, muss der BRAF-V600E-Nachweis durch einen alternativen validierten Test erbracht werden.<ref name=":0" /> | |||
Wirksamkeit und Sicherheit des Arzneistoffs bei Patienten mit einem nicht-mutierten BRAF-Protein sind nicht belegt. | |||
==Darreichungsform== | ==Darreichungsform== | ||
Dabrafenib | Dabrafenib steht in Form von [[Hartkapsel|Hartkapseln]] und [[Tablette|Tabletten]] zur Herstellung einer [[Suspension]] zur [[oral]]en Applikation zur Verfügung. | ||
==Dosierung== | ==Dosierung== | ||
Die empfohlene | Die empfohlene Dosierung beträgt bei Erwachsenen zweimal täglich 150 mg Dabrafenib allein oder in Kombination mit einmal täglich 2 mg Trametinib. Die Einnahme soll mindestens eine Stunde vor einer Mahlzeit erfolgen. Im weiteren Verlauf der Behandlung erfolgt eine schrittweise Dosisreduktion.<ref name="fachinfo"></ref> | ||
Bei pädiatrischen Patienten ist eine körpergewichtsbezogene Dosierung notwendig.<ref name=":0" /> | |||
{{dosis}} | {{dosis}} | ||
==Nebenwirkungen== | ==Nebenwirkungen== | ||
Die häufigsten unerwünschten Wirkungen (≥ 20 %) von Dabrafenib sind:<ref name=":0" /> | |||
* [[Pyrexie]] (nicht-infektiös) mit [[Rigor]], [[Dehydration]], [[Hypotonie]] und/oder akuter [[Prärenal|prärenaler]] [[Niereninsuffizienz]] | |||
* [[Exanthem]], [[Akneiform|akneiforme]] [[Dermatitis]] | |||
* [[Kopfschmerzen]] | |||
* [[Übelkeit]], [[Erbrechen]], [[Diarrhö]], [[Abdominalschmerz]] | |||
* [[Fatigue]] | |||
* [[Hauttrockenheit]] | |||
* [[Blutung|Blutungen]] | |||
* [[Neutropenie]] | |||
* [[Husten]] | |||
* Anstieg der [[Transaminasen]] | |||
Unter der Therapie mit Dabrafenib wurde die Entstehung neuer gutartiger und bösartiger Neubildungen beobachtet, darunter kutane Malignome (z.B. [[Plattenepithelkarzinom|Plattenepithelkarzinome]] (cuSCC), [[Keratoakanthom|Keratoakanthome]], neue primäre Melanome). Maligne Tumoren anderer Organe betreffen die [[Blutbildung]] ([[chronische myelomonozytäre Leukämie]]), nicht-kutane Plattenepithelkarzinome des Kopf- und Halsbereichs, die Bauchspeicheldrüse ([[Pankreaskarzinom]] bei Monotherapie und in Kombination mit Trametinib), die Gallenwege ([[Adenokarzinom]]) und das Kolon (in Kombination mit Trametinib ([[kolorektales Karzinom]]). | |||
Durch eine Schädigung der Augen (z.B. [[Uveitis]], [[Iritis]], [[Iridozyklitis]]) kann es zu Sehstörungen, [[Photophobie]] und Augenschmerzen kommen. | |||
Innerhalb von 2 und 5 Monaten nach Behandlungsbeginn kann sich eine [[linksventrikuläre Dysfunktion]] bis hin zur [[Herzinsuffizienz]] ausprägen. | |||
Weitere schwerwiegende Nebenwirkungen (z.B. [[Stevens-Johnson-Syndrom]], [[DRESS-Syndrom]], [[Rhabdomyolyse]], [[Pankreatitis]], [[Kolitis]], [[Gastrointestinal|gastrointestinale]] [[Perforation]], [[tiefe Venenthrombose]], [[Lungenembolie]], [[Sarkoidose]], [[hämophagozytische Lymphohistiozytose]]) können tödlich verlaufen.<ref name=":0" /> | |||
==Wechselwirkungen== | ==Wechselwirkungen== | ||
Da Dabrafenib ein [[Substrat]] von CYP2C8 und CYP3A4 ist, sollte die gleichzeitige Einnahme mit starken [[Induktor]]en dieser [[Enzym]]e vermieden werden. Mittel, die den [[pH-Wert]] des [[Magen]]s erhöhen, wie zum Beispiel [[Protonenpumpenhemmer]], können die Bioverfügbarkeit von Dabrafenib verringern. | Da Dabrafenib ein [[Substrat]] von CYP2C8 und CYP3A4 ist, sollte die gleichzeitige Einnahme mit starken [[Induktor]]en dieser [[Enzym]]e vermieden werden, da sonst mit einem Wirkungsverlust zu rechnen ist. Mittel, die den [[pH-Wert]] des [[Magen]]s erhöhen, wie zum Beispiel [[Protonenpumpenhemmer]], können die Bioverfügbarkeit von Dabrafenib verringern. | ||
Dabrafenib ist ein Induktor der Enzyme bzw. Enzymgruppen CYP3A4, [[CYP2C]] und [[CYP2B6]] und kann zu einem Wirkverlust zahlreicher Arzneimittel führen. Die [[Fachinformation]] enthält eine | Dabrafenib ist ein Induktor der Enzyme bzw. Enzymgruppen CYP3A4, [[CYP2C]] und [[CYP2B6]] und kann zu einem Wirkverlust zahlreicher Arzneimittel führen. Die [[Fachinformation]] enthält eine detaillierte Angaben zu möglichen weiteren Interaktionen.<ref name="fachinfo"></ref> | ||
==Kontraindikationen== | ==Kontraindikationen== | ||
* [[Überempfindlichkeit]] | * [[Überempfindlichkeit]] gegen Dabrafenib oder einen der sonstigen Bestandteile des Arzneimittels. | ||
== Schwangerschaft und Stillzeit == | |||
Bei männlichen Patienten kann es durch die Behandlung mit Dabrafenib zu einer irreversiblen Schädigung der [[Spermatogenese]] mit [[Infertilität]] kommen. | |||
Bei [[Tierexperiment|tierexperimentelle Untersuchungen]] wurden [[Reproduktionstoxizität|reproduktionstoxische]] und [[Teratogenität|teratogene]] Wirkungen festgestellt. Dabrafenib kann die Wirksamkeit von oralen oder systemischen hormonellen [[Kontrazeptiva]] verringern, daher sollte eine andere zuverlässige Verhütungsmethode angewendet werden. Frauen im gebärfähigen Alter müssen während der Therapie und 2 Wochen nach dem Absetzen von Dabrafenib sowie 16 Wochen nach Beendigung der Behandlung mit Trametinib eine zuverlässige Verhütungsmethode anwenden.<ref name=":0" /> | |||
Es ist nicht bekannt, ob Dabrafenib in die [[Muttermilch]] übertritt. Ob das Stillen zu unterbrechen ist oder auf die Behandlung während der Stillzeit verzichtet werden soll, ist im Einzelfall zu entscheiden. | |||
== Toxizität == | |||
Es liegen aktuell (2024) keine Erfahrungen zur Symptomatik einer [[Überdosierung]] oder [[Vergiftung]] mit Dabrafenib vor. Es ist davon auszugehen, dass es im Zusammenhang mit einer Pyrexie zu akut lebensbedrohlichen Verläufen kommen kann. Eine [[Primäre Entgiftung|primäre Giftentfernung]] durch Verabreichung von [[Aktivkohle]] kann innerhalb einer Stunde nach der [[Ingestion]] erfolgen. Die weitere Behandlung erfolgt in jedem Fall symptomatisch. Ein spezifisches [[Antidot]] steht bisher (2024) nicht zur Verfügung. Aufgrund seiner pharmakokinetischen Eigenschaften (hohe Plasmaproteinbindung) ist eine [[Sekundäre Entgiftung|sekundäre Giftentfernung]] durch [[Hämodialyse]] nicht effektiv. | |||
==Zulassung== | ==Zulassung== | ||
Dabrafenib | Dabrafenib wurde 2013 für die Behandlung Erwachsener<ref>[https://www.ema.europa.eu/en/medicines/human/EPAR/tafinlar Tafinlar]. EMA, abgerufen am 02.05.2024</ref> und 2023 für Kinder<ref>[https://www.ema.europa.eu/en/medicines/human/EPAR/finlee Finlee], EMA, abgerufen am 02.05.204</ref> durch die [[EMA]] zugelassen. | ||
==Nutzenbewertung== | == Nutzenbewertung == | ||
Ein [[Zusatznutzen]] einer Therapie mit Dabrafenib wird vom [[G-BA]] auf der Basis der vom [[IQWiG]] ausgewerteten Studienergebnisse wie folgt eingeordnet:<ref name="IQWIG"></ref> | Ein [[Zusatznutzen]] einer Therapie mit Dabrafenib wird vom [[G-BA]] auf der Basis der vom [[IQWiG]] ausgewerteten Studienergebnisse wie folgt eingeordnet:<ref name="IQWIG">IQWIG-Berichte-Nr.524 Dabrafenib | ||
(nicht kleinzelliges Lungenkarzinom) – [https://www.iqwig.de/de/projekte-ergebnisse/projekte-301/arzneimittelbewertung/2017/a17-17-dabrafenib-nicht-kleinzelliges-lungenkarzinom-nutzenbewertung-gemaess-35a-sgb-v.7894.html Nutzenbewertung gemäß § 35a SGB V] abgerufen am 29.11.2018 </ref> | |||
* nicht belegter Zusatznutzen gegenüber einer [[zweckmäßige Vergleichstherapie|zweckmäßigen Vergleichstherapie]] | * nicht belegter Zusatznutzen gegenüber einer [[zweckmäßige Vergleichstherapie|zweckmäßigen Vergleichstherapie]]. | ||
==Kosten== | ==Kosten== | ||
Die [[Jahrestherapiekosten]] betragen pro Patient rund 140.000 €.<ref name="IQWIG"></ref> | Die [[Jahrestherapiekosten]] betragen pro Patient rund 140.000 €.<ref name="IQWIG"></ref> | ||
== ATC-Code == | |||
* L01EC02 - Antineoplastische und immunmodulierende Mittel - Antineoplastische Mittel - Proteinkinase-Inhibitoren - BRAF-Serin-Threoninkinase-Inhibitoren | |||
==Quellen== | ==Quellen== | ||
<references/> | <references/> | ||
==Weblinks== | |||
*[https://go.drugbank.com/drugs/DB08912 Drugbank - Dabrafenib], abgerufen am 02.05.2024 | |||
*[https://www.pharmazeutische-zeitung.de/arzneistoffe/daten/2013/dabrafenibtafinlar174862013/ Pharmazeutische Zeitung Arzneistoffe - Dabrafenib], abgerufen am 02.05.2024 | |||
*[https://www.gelbe-liste.de/wirkstoffe/Dabrafenib_52140 Gelbe Liste Wirkstoffe - Dabrafenib], abgerufen am 02.05.2024 | |||
*[https://www.pharmawiki.ch/wiki/index.php?wiki=Dabrafenib PharmaWiki - Dabrafenib], abgerufen am 02.05.2024 | |||
*{{PubChem|44462760}} | |||
*{{MeSH|67561627}} | |||
[[Fachgebiet:Arzneimittel]] | [[Fachgebiet:Arzneimittel]] | ||
[[Tag:Melanom]] | [[Tag:Melanom]] | ||
[[Tag:Proteaseinhibitor]] | [[Tag:Proteaseinhibitor]] | ||
[[Tag:Serin/Threonin-Kinase]] | [[Tag:Serin/Threonin-Kinase]] | ||
[[Tag: | [[Tag:Zytostatikum]] | ||
[[Kategorie:Pharmakologie]] | |||
[[Kategorie:Gliom]] | |||
[[Kategorie:Nicht-kleinzelliges Bronchialkarzinom]] | |||
[[Kategorie:BRAF-V600-Mutation]] | |||
Aktuelle Version vom 3. Mai 2024, 23:00 Uhr
Handelsnamen: Finlee®, Tafinlar®
Synonym: GSK-2118436
Englisch: dabrafenib
Definition
Dabrafenib ist ein antineoplastischer Arzneistoff aus der Klasse der Proteinkinase-Inhibitoren. Es handelt sich um einen BRAF-Kinase-Inhibitor, der als Monotherapie oder in Kombination mit Trametinib zur Behandlung des malignen Melanoms, des nicht-kleinzelligen Bronchialkarzinoms (NSCLC) und des Glioms eingesetzt wird, wenn eine BRAF-V600E-Mutation der Tumorzellen nachgewiesen wurde.
Chemie
Dabrafenib ist ein Pyrimidin- und ein Thiazol--Derivat. Der Wirkstoff wird über mehrere Zwischenstufen aus 3-Brom-2-fluorbenzoesäure, Methanol und anderen organischen Verbindungen synthetisiert. Die Summenformel ist C23H20F3N5O2S2. Der chemische Name lautet
- N-[3-[5-(2-Aminopyrimidin-4-yl)-2-tert-butyl-1,3-thiazol-4-yl]-2-fluorophenyl]-2,6-difluorbenzensulfonamid (IUPAC)
Die molare Masse beträgt 519,6g/mol, der Oktanol-Wasser-Koeffizient (logP) 5,44. Die CAS-Nummer ist 1195765-45-7. Als Arzneistoff wird Dabrafenibmesilat verwendet, ein Salz der Methylsulfonsäure (MSS), ein weißes bis leicht gefärbtes Pulver, das in Wasser praktisch unlöslich ist.
Wirkmechanismus
Dabrafenib bindet selektiv an die Serin-Threonin-Kinase BRAF und blockiert dadurch die Aktivierung des RAS/ RAF/MEK/ERK-Signalwegs, der an der Steuerung des Zellwachstums beteiligt ist. Onkogene Mutationen im BRAF-Gen können eine Überaktivität des Signalwegs hervorrufen, was zu unkontrolliertem Zellwachstum und damit zu Krebs führen kann. Dadurch werden von diesem Signalweg abhängige Transkriptionsfaktoren nicht mehr phosphoryliert und es kommt bei einer Vielzahl von Zielgenen zum Abbruch der Transkription, sodass die Proliferation der Tumorzellen blockiert und das Wachstum des Tumors gestoppt wird.[1][2]
Dabrafenib ist gegen die BRAF-Varianten V600E, V600K und V600D wirksam.
Pharmakokinetik
Dabrafenib wird nach oraler Aufnahme rasch resorbiert. Maximale Plasmaspiegel werden nach 1,5 bis 2 Stunden erreicht. Die Bioverfügbarkeit erreicht 95 %. Die Plasmaproteinbindung beträgt 100 %, das Verteilungsvolumen 46 Liter (ca. 0,7 l/kgKG). Die Biotransformation in der Leber erfolgt über die Cytochrom-P450-Isoenzyme CYP2C8 und CYP3A4. Die Elimination der Metaboliten erfolgt zu 71 % mit den Fäzes und zu 23 % mit dem Urin. Die Eliminationshalbwertszeit beträgt etwa 10 Stunden.[1]
Indikation
- Monotherapie von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation[1]
- Kombinationstherapie mit Trametinib
- bei erwachsenen Patienten mit fortgeschrittenem nicht-kleinzelligem Bronchialkarzinom (NSCLC) mit einer BRAF-V600-Mutation[1]
- bei pädiatrischen Patienten ab einem Alter von einem Jahr mit einem niedriggradig malignem Gliom mit einer BRAF-V600E-Mutation, die eine systemische Therapie benötigen[3]
- bei pädiatrischen Patienten ab einem Alter von einem Jahr mit einem hochgradig malignem Gliom mit einer BRAF-V600E-Mutation, die zuvor mindestens eine Strahlen- und/oder Chemotherapie erhalten haben[3]
Besondere Hinweise
Vor der Anwendung von Dabrafenib muss beim Patienten die BRAF-V600E-Mutation mittels eines In-vitro-Diagnostikums (IVD) mit CE-Kennzeichnung mit der entsprechenden Zweckbestimmung bestätigt worden sein. Sollte ein IVD mit CE-Kennzeichnung nicht verfügbar sein, muss der BRAF-V600E-Nachweis durch einen alternativen validierten Test erbracht werden.[3]
Wirksamkeit und Sicherheit des Arzneistoffs bei Patienten mit einem nicht-mutierten BRAF-Protein sind nicht belegt.
Darreichungsform
Dabrafenib steht in Form von Hartkapseln und Tabletten zur Herstellung einer Suspension zur oralen Applikation zur Verfügung.
Dosierung
Die empfohlene Dosierung beträgt bei Erwachsenen zweimal täglich 150 mg Dabrafenib allein oder in Kombination mit einmal täglich 2 mg Trametinib. Die Einnahme soll mindestens eine Stunde vor einer Mahlzeit erfolgen. Im weiteren Verlauf der Behandlung erfolgt eine schrittweise Dosisreduktion.[1]
Bei pädiatrischen Patienten ist eine körpergewichtsbezogene Dosierung notwendig.[3]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Die häufigsten unerwünschten Wirkungen (≥ 20 %) von Dabrafenib sind:[3]
- Pyrexie (nicht-infektiös) mit Rigor, Dehydration, Hypotonie und/oder akuter prärenaler Niereninsuffizienz
- Exanthem, akneiforme Dermatitis
- Kopfschmerzen
- Übelkeit, Erbrechen, Diarrhö, Abdominalschmerz
- Fatigue
- Hauttrockenheit
- Blutungen
- Neutropenie
- Husten
- Anstieg der Transaminasen
Unter der Therapie mit Dabrafenib wurde die Entstehung neuer gutartiger und bösartiger Neubildungen beobachtet, darunter kutane Malignome (z.B. Plattenepithelkarzinome (cuSCC), Keratoakanthome, neue primäre Melanome). Maligne Tumoren anderer Organe betreffen die Blutbildung (chronische myelomonozytäre Leukämie), nicht-kutane Plattenepithelkarzinome des Kopf- und Halsbereichs, die Bauchspeicheldrüse (Pankreaskarzinom bei Monotherapie und in Kombination mit Trametinib), die Gallenwege (Adenokarzinom) und das Kolon (in Kombination mit Trametinib (kolorektales Karzinom).
Durch eine Schädigung der Augen (z.B. Uveitis, Iritis, Iridozyklitis) kann es zu Sehstörungen, Photophobie und Augenschmerzen kommen.
Innerhalb von 2 und 5 Monaten nach Behandlungsbeginn kann sich eine linksventrikuläre Dysfunktion bis hin zur Herzinsuffizienz ausprägen.
Weitere schwerwiegende Nebenwirkungen (z.B. Stevens-Johnson-Syndrom, DRESS-Syndrom, Rhabdomyolyse, Pankreatitis, Kolitis, gastrointestinale Perforation, tiefe Venenthrombose, Lungenembolie, Sarkoidose, hämophagozytische Lymphohistiozytose) können tödlich verlaufen.[3]
Wechselwirkungen
Da Dabrafenib ein Substrat von CYP2C8 und CYP3A4 ist, sollte die gleichzeitige Einnahme mit starken Induktoren dieser Enzyme vermieden werden, da sonst mit einem Wirkungsverlust zu rechnen ist. Mittel, die den pH-Wert des Magens erhöhen, wie zum Beispiel Protonenpumpenhemmer, können die Bioverfügbarkeit von Dabrafenib verringern. Dabrafenib ist ein Induktor der Enzyme bzw. Enzymgruppen CYP3A4, CYP2C und CYP2B6 und kann zu einem Wirkverlust zahlreicher Arzneimittel führen. Die Fachinformation enthält eine detaillierte Angaben zu möglichen weiteren Interaktionen.[1]
Kontraindikationen
- Überempfindlichkeit gegen Dabrafenib oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft und Stillzeit
Bei männlichen Patienten kann es durch die Behandlung mit Dabrafenib zu einer irreversiblen Schädigung der Spermatogenese mit Infertilität kommen.
Bei tierexperimentelle Untersuchungen wurden reproduktionstoxische und teratogene Wirkungen festgestellt. Dabrafenib kann die Wirksamkeit von oralen oder systemischen hormonellen Kontrazeptiva verringern, daher sollte eine andere zuverlässige Verhütungsmethode angewendet werden. Frauen im gebärfähigen Alter müssen während der Therapie und 2 Wochen nach dem Absetzen von Dabrafenib sowie 16 Wochen nach Beendigung der Behandlung mit Trametinib eine zuverlässige Verhütungsmethode anwenden.[3]
Es ist nicht bekannt, ob Dabrafenib in die Muttermilch übertritt. Ob das Stillen zu unterbrechen ist oder auf die Behandlung während der Stillzeit verzichtet werden soll, ist im Einzelfall zu entscheiden.
Toxizität
Es liegen aktuell (2024) keine Erfahrungen zur Symptomatik einer Überdosierung oder Vergiftung mit Dabrafenib vor. Es ist davon auszugehen, dass es im Zusammenhang mit einer Pyrexie zu akut lebensbedrohlichen Verläufen kommen kann. Eine primäre Giftentfernung durch Verabreichung von Aktivkohle kann innerhalb einer Stunde nach der Ingestion erfolgen. Die weitere Behandlung erfolgt in jedem Fall symptomatisch. Ein spezifisches Antidot steht bisher (2024) nicht zur Verfügung. Aufgrund seiner pharmakokinetischen Eigenschaften (hohe Plasmaproteinbindung) ist eine sekundäre Giftentfernung durch Hämodialyse nicht effektiv.
Zulassung
Nutzenbewertung
Ein Zusatznutzen einer Therapie mit Dabrafenib wird vom G-BA auf der Basis der vom IQWiG ausgewerteten Studienergebnisse wie folgt eingeordnet:[6]
- nicht belegter Zusatznutzen gegenüber einer zweckmäßigen Vergleichstherapie.
Kosten
Die Jahrestherapiekosten betragen pro Patient rund 140.000 €.[6]
ATC-Code
- L01EC02 - Antineoplastische und immunmodulierende Mittel - Antineoplastische Mittel - Proteinkinase-Inhibitoren - BRAF-Serin-Threoninkinase-Inhibitoren
Quellen
- ↑ Hochspringen nach: 1,0 1,1 1,2 1,3 1,4 1,5 Fachinformation Tafinlar, Novartis Pharma, abgerufen am 02.05.2024
- ↑ Pharmazeutische Zeitung Online Arzneistoffe | Dabrafenib abgerufen am 29.11.18
- ↑ Hochspringen nach: 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Zusammenfassung der Merkmale des Arzneimittels Finlee, EMA, abgerufen am 02.05.2024
- ↑ Tafinlar. EMA, abgerufen am 02.05.2024
- ↑ Finlee, EMA, abgerufen am 02.05.204
- ↑ Hochspringen nach: 6,0 6,1 IQWIG-Berichte-Nr.524 Dabrafenib (nicht kleinzelliges Lungenkarzinom) – Nutzenbewertung gemäß § 35a SGB V abgerufen am 29.11.2018
Weblinks
- Drugbank - Dabrafenib, abgerufen am 02.05.2024
- Pharmazeutische Zeitung Arzneistoffe - Dabrafenib, abgerufen am 02.05.2024
- Gelbe Liste Wirkstoffe - Dabrafenib, abgerufen am 02.05.2024
- PharmaWiki - Dabrafenib, abgerufen am 02.05.2024
- PubChem: 44462760
- MeSH: 67561627