Autoimmunhämolytische Anämie
Abkürzung: AIHA
Englisch: autoimmune h(a)emolytic an(a)emia
Definition
Die autoimmunhämolytische Anämie ist eine Form der hämolytischen Anämie, bei der das körpereigene Immunsystem Antikörper bildet, welche eine Hämolyse der Erythrozyten induzieren.
Einteilung
Die autoimmunhämolytischen Anämien können in drei Gruppen eingeteilt werden:
- Autoimmunhämolytische Anämie mit Wärmeantikörpern (IgG) - ca. 70 %
- Autoimmunhämolytische Anämie mit Kälteantikörpern (IgM) - ca. 20 %
- Autoimmunhämolytische Anämie mit gemischten bzw. bithermischen Autoantikörpern (Donath-Landsteiner-Antikörper) - ca. 10 %
Die autoimmunhämolytische Anämie gehört zu den hyperregeneratorischen Anämien.
Ätiologie und Pathophysiologie
Gemeinsames Merkmal der autoimmunhämolytischen Anämien ist das Vorhandensein von Autoantikörpern, die an die Oberfläche von Erythrozyten binden und so durch eine Aktivierung des Komplementsystems oder der zellulären Immunität (Makrophagen, T-Lymphozyten) zu einer Hämolyse führen. Die Hämolyse kann intravasal (meistens komplementvermittelt) und extravasal (Lyse antikörperbeladener Erythrozyten durch Makrophagen im RHS) erfolgen.
Im folgenden sollen ätiologische und pathophysiologische Aspekte der einzelnen Gruppen erläutert werden.
AIHA mit Wärmeantikörpern
Wärmeantikörper binden bei Körpertemperatur an die Erythrozyten. Die derart markierten Erythrozyten werden bei Passage der Milz und der Leber (Retikuloendotheliales System) durch Makrophagen zerstört (extravasale Hämolyse). Bei hohem Antikörpertiter ist die Lebenszeit der Erythrozyten so stark verkürzt, dass auch eine maximal gesteigerte Erythropoese nicht für einen ausreichenden Nachschub an Erythrozyten sorgen kann. Es entsteht eine Anämie.
Die Ursache einer AIHA mit Wärmeantikörpern ist in etwa der Hälfte der Fälle unbekannt, man spricht in diesem Zusammenhang von einer idiopathischen AIHA. Sekundäre Formen der AIHA mit Wärmeantikörpern treten im Rahmen einer anderen Grunderkrankung oder induziert durch Medikamente auf, darunter unter anderem:
- Systemischer Lupus erythematodes und andere Kollagenosen
- Non-Hodgkin-Lymphom (z.B. CLL)
- Morbus Hodgkin
- Virusinfekte (vor allem bei Kindern)
- Medikamente: Bei den medikamentös induzierten AIHA werden drei Formen unterschieden:
- α-Methyldopa-Typ (Autoimmunreaktion im engeren Sinne): Das Medikament induziert medikamentenunabhängige IgG-Autoantikörper, auch z.B. bei Fludarabin
- Penicillin-Typ (Typ-II-Allergie): Das Medikament bindet als Hapten an die Erythrozytenmembran und induziert die IgG-Antikörperbildung, d.h. die Antikörper zerstören die Erythrozyten nur in Anwesenheit des Arzneimittels
- Chinidin-Typ (Typ-III-Allergie): Das Medikament bildet mit IgM- oder IgG-Antikörpern einen Immunkomplex, der an die Erythrozyten bindet und über eine Komplementaktivierung zur Zelllyse führt; auch z.B. bei Cephalosporinen.
AIHA mit Kälteantikörpern
Kälteantikörper sind IgM-Antikörper, die an Erythrozyten gebunden bei niedrigen Temperaturen (Optimum bei 0 - 5 °C) über eine Komplementaktivierung zur Hämolyse führen (intravasale Hämolyse). Je nach der unterschiedlich ausgeprägten Bindungsfähigkeit und Fähigkeit zur Komplementaktivierung, variiert die Schwere der Anämie. Kälteantikörperbeladene Erythrozyten agglutinieren im Körper am ehesten an den Akren, an denen im Gegensatz zum Körperkern eine niedrigere Temperatur (ca. 30 °C) vorherrscht.
Eine AIHA mit Kälteantikörpern kommt als akute und chronische Form vor. Ein akutes Auftreten (akute Kälteagglutininkrankheit) erfolgt in der Regel 2-4 Wochen nach einer Infektion mit Mykoplasmen, seltener auch bei EBV und dem Rubellavirus. In der Regel kommt es zu einer Spontanremission innerhalb weniger Wochen.
Chronische Verläufe (chronische Kälteagglutininkrankheit) sind in der Regel Begleiterscheinung eines Non-Hodgkin-Lymphoms, selten treten sie auch idiopathisch auf.
AIHA mit gemischten Antikörpern
Die AIHA mit gemischten Antikörpern (paroxysmale Kältehämoglobinurie) kommt meist bei Kindern und Jugendlichen in der Folge eines Virusinfekts vor. Sie ist durch einen raschen und plötzlichen Beginn und spontane Remission gekennzeichnet.
Die früher geläufigere, gemischte AIHA bei Syphilis sieht man heute nur noch selten, da die Syphilis in der Regel bereits in einem früheren Krankheitsstadium zur Behandlung kommt.
Klinik
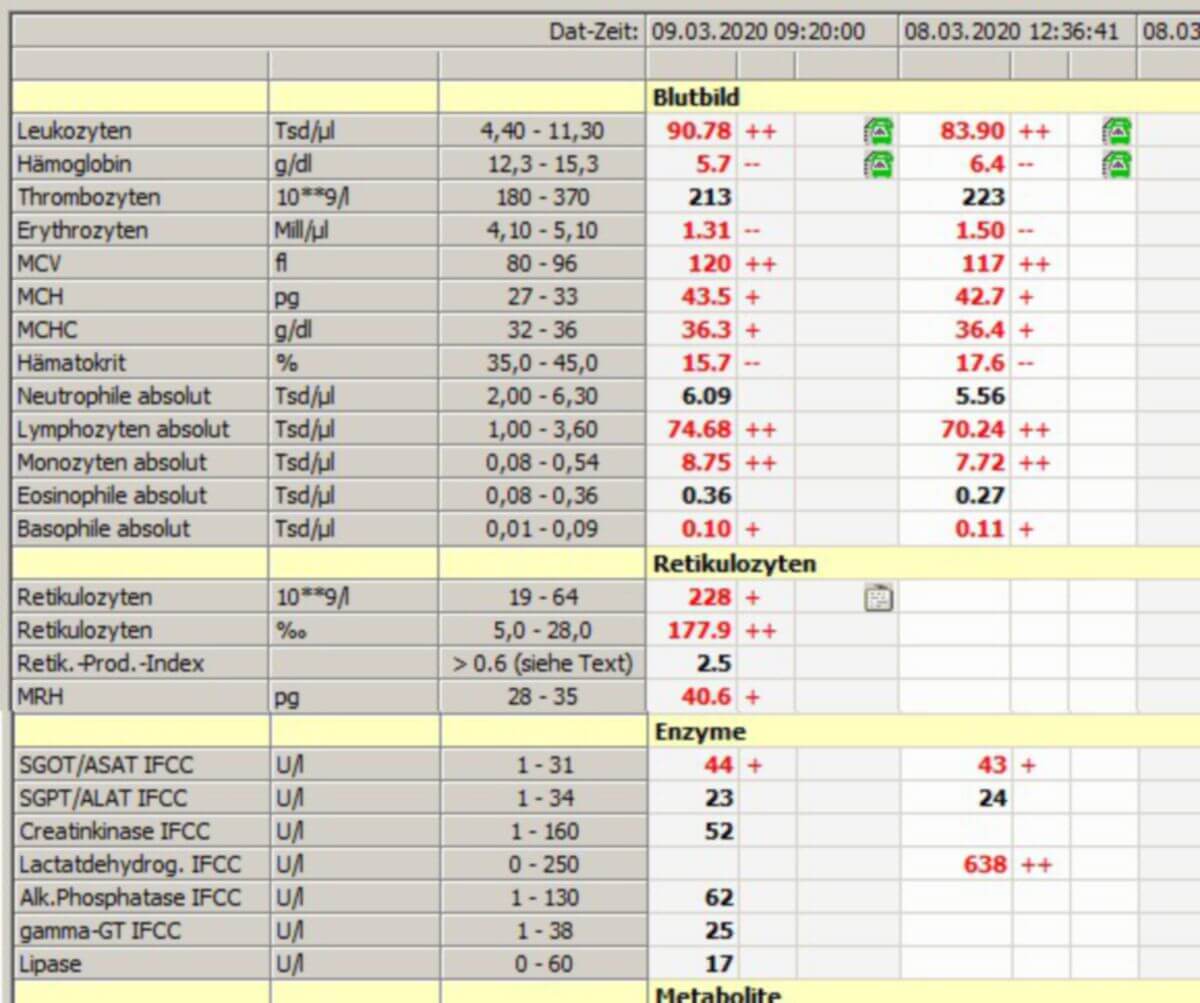
Labordiagnostisch fallen die autoimmunhämolytischen Anämien durch eine normochrome Anämie mit Hämolysezeichen (Erhöhung von LDH, indirektem Bilirubin) auf. Durch die gesteigerte Regeneration ist die Retikulozytenzahl erhöht. Bei intravasaler Hämolyse sinkt die Konzentration von Haptoglobin. Je nach Art der hämolytischen Anämie können sich weitere diagnostische Verdachtsmomente ergeben.
Bei vorhandenen Wärmeantikörpern ist eine stark beschleunigte BSG mit ungeordneter Sedimentation zu beobachten. Im Labor können eventuell die Blutgruppenbestimmung und die serologische Verträglichkeitsprobe (Kreuzprobe) problematisch sein (Interferenz der Wärmeantikörper).
Bei Kälteantikörpern ist die akute Form durch eine rasch auftretende intravasale Hämolyse mit Hämoglobinurie charakteristisch. Nach Kälteexposition kann es zu einer Akrozyanose kommen, die sich bei Aufwärmen der Finger wieder bessert. Auch hämolytische Schübe nach wiederholter Kälteexposition sind typisch. Bei der Blutentnahme kann es bereits in der Punktionskanüle zur Gerinnung kommen, die Kreuzprobe und die Anfertigung eines Blutausstriches sind problematisch. Bei Verdacht auf Kälteantikörper sollte die Blutentnahme daher so erfolgen, dass das Blut warm ins Labor transportiert wird (Warmblutprobe).
AIHA mit gemischten Antikörpern sollten bei Hämolysen unklarer Art bei Kindern und Jugendlichen im Rahmen der Differentialdiagnose bedacht werden.
Diagnostik
Bei Verdacht auf eine autoimmunhämolytische Anämie sind eine Reihe von Tests notwendig, um die Diagnose zu sichern und die Art der Antikörper zu bestimmen.
Wegweisend ist der Coombs-Test. Der direkte Coombs-Test ist bei einer AIHA in der Regel positiv. Ein negativer direkter Coombstest schließt eine AIHA allerdings nicht sicher aus (sog. Coombs-negative AIHA). Die weitere Diagnostik umfasst die Bestimmung der Autoantikörper und die Umfelddiagnostik.
Wärmeantikörper
Bei Wärmeantikörpern finden sich oft eine stark beschleunigte BSG sowie Hämolyseparameter. Es sollte eine Medikamentenanamnese und eine Diagnostik auf Lymphome und SLE erfolgen.
Kälteantikörper
Bei Kälteantikörpern ist die genauere Bestimmung der Kälteagglutinine diagnostisch hilfreich:
- Kälteagglutinine vom Typ Anti-i-Kälteantikörper finden sich im Rahmen einer EBV-Infektion und bei Lymphomen
- Kälteagglutinine vom Typ Anti-l-Kälteantikörper kommen bei Mykoplasmen-Infektionen und benigner monoklonaler Gammopathie vor.
Kälte-Antikörper bis zu einem Titer von 1:32 sind beim gesunden Menschen als normal zu werten. Ein erhöhter Titer an Kälte-Antikörpern findet sich bei:
- Kälteagglutininsyndrom (erworben): Titer oft um 1: 1.000
- Kälteagglutininkrankheit (angeboren): Titer oft 1: > 1.000
Donath-Landsteiner-Antikörper
Bei der Suche nach gemischten Antikörpern kann der Donath-Landsteiner-Test mit Abkühlung und Wiedererwärmung der Probe hilfreich sein.
Therapie
Die Therapie der autoimmunhämolytischen Anämien hat Aussicht auf bleibenden Erfolg, wenn die zugrundeliegende Ursache gefunden und erfolgreich therapiert werden kann. Dies kann beispielsweise ein Absetzen auslösender Medikamente, die Behandlung eines SLE oder die Therapie eines zugrundeliegenden Lymphoms sein.
Bei ausgeprägten Hämolysen sollte zur Prophylaxe einer Thrombose stets eine Heparinisierung (low-dose) erfolgen.
Bei vorhandenen Wärmeantikörpern kann eine konsequente Therapie mit Glukokortikoiden über drei bis vier Wochen zum Sistieren der Hämolyse führen. Bei einer hämolytischen Krise können kurzfristig hochdosierte Steroide oder Immunglobulin-Präparate verwendet werden. Bei kortikoidresistenten Verläufen kommen Immunsuppressiva (Azathioprin, Cyclophosphamid, Rituximab, Mycophenolat, Ciclosporin A) in Frage. Liegt bei chronischen Verläufen eine Hämolyse vorwiegend in der Milz vor (Szintigraphie mit 51Cr-Na-Chromat-markierten Erythrozyten), kann eine Splenektomie erwogen werden.
Bei Kälteantikörpern ist ein effektiver Schutz vor Kälte, insbesondere im Bereich der Akren ("Handschuhe und Pantoffeln"), die wichtigste und in leichten Fällen auch eine ausreichende Maßnahme. Glukokortikoide und eine Splenektomie sind unwirksam. Bei chronischen Fällen mit wiederholten Hämolysen werden daher Rituximab mit Bendamustin, Chlorambucil, Cyclophosphamid oder Bortezomib eingesetzt. In schweren Fällen kann zusätzlich eine Plasmapherese zur Elimination bereits zirkulierender Autoantikörper erfolgen. Bei sehr schwerer hämolytischer Krise kann die Gabe von Eculizumab erwogen werden. Sutimlimab, ein monoklonaler Anti-C1s-Antikörper, ist seit 2022 in den USA zugelassen.
Bluttransfusionen sind bei Patienten mit AIHA fast immer problematisch und daher nach Möglichkeit zu vermeiden, indem man die Hb-Grenzen zur Transfusion niedriger setzt. Die Patienten sind häufig an eine niedrige Hb-Konzentration adaptiert. Insbesondere bei vorhandenen Wärmeautoantikörpern können zusätzliche Alloantikörper gegen Erythrozytenantigene (irreguläre erythrozytäre Antikörper) nicht sicher ausgeschlossen werden. Zudem kann durch Transfusionen ein neuer Reiz zur Bildung von Autoantikörpern gesetzt werden.
Eine Transfusion sollte mit Rhesus-Kell-kompatiblen Erythrozytenkonzentraten (EK) ohne "Buffy Coat" unter strenger Überwachung erfolgen - diese EK sind heute (2022) Standard. Bei Unverträglichkeitsreaktionen trotz Vorsichtsmaßnahmen sollte auf gewaschene Erythrozytenkonzentrate zurückgegriffen werden.
Des Weiteren sollte an eine Supplementierung von Folsäure (5 mg pro Tag) und ggf. Vitamin B12 gedacht werden.
Literatur
- Laborlexikon.de, abgerufen am 8.2.2021