FlexiEssay: Reaktionsschritte des Citratzyklus
Dieser Text ein so genannter FlexiEssay. So nennen wir Texte, die keinen lexikalischen Inhalt haben. FlexiEssays geben die persönliche Einschätzung des Autors wieder. Sie werden von uns nicht inhaltlich überprüft. Wie bei allen anderen Texten gilt: Lies dir den Artikel kritisch durch, vergleiche ihn mit anderen Publikationen und bilde dir eine eigene Meinung.
Definition
Der Citratzyklus wird auch als "Drehscheibe des Stoffwechsels" bezeichnet, da er im Zentrum zahlreicher Stoffwechselwege liegt. Dieser ist zyklisch und befindet sich in der mitochondrialen Matrix, in dem pro Reaktionzyklus ein Acetylrest unter Energiegewinn zu zwei Molekülen CO2 oxidiert wird. Am Beginn des Citronensäurezyklus wird der Acetylrest auf ein Oxalacetat übertragen, wobei Citrat entsteht (Namensgebung).
Allgemein
Die wichtigste Aufgabe des Citratzyklus besteht darin, dass Acetylreste oxidiert werden, damit Elektronen für die Atmungskette gewonnen werden können.
Pro Zyklus wird Energie frei, die gespeichert wird in:
- 3 NADH,
- 1 FADH2, bei beiden werden Elektronen an die Atmungskette abgegeben, sowie
- 1 GTP - dieses kann zur Bildung von ATP genutzt werden.
Hierbei wird der Acetylrest von Acetyl-CoA auf Oxalacetat übertragen, woraus Citrat (Anion der Zitronensäure) entsteht, welches 6 C-Atome enthält. Im Laufe des Zyklus werden zwei (von den ursprünglichen 6 Kohlenstoffatomen) in Form von Kohlendioxid (CO2) abgespalten, wobei schlussendlich eine Verbindung von 4 C-Atomen entsteht: Oxalacetat. In einem neuen Reaktionszyklus kann dieses wieder einen Acetylrest aufnehmen. Da bei der Oxidation Elektronen anfallen, werden diese in Form von NADH und FADH2 gesammelt und an die Atmungskette abgegeben und eingeschleust. Diese baut den Protonengradienten auf, weshalb die mitochondriale ATP-Synthase angetrieben wird. Dies ist auch der Grund, wieso der Citratzyklus indirekt zur ATP-Synthese beiträgt.
Um die einzelnen Reaktionsschritte verstehen zu können, müssen vorab einige Fakten und grundlegende Funktionen des Ablaufs erklärt werden, bzw. muss ein Verständnis für die Dehydrogenasen (ausschlaggebende Enzyme) entwickelt werden. Nachdem diese verstanden wurden, können die einzelnen Schritte leichter erlernt und verstanden werden.
Zusätzliche Funktionen
Der Citratzyklus erledigt zusätzlich noch folgende Funktionen:
- Für alle Aminosäuren, die nicht zu Pyruvat oder zu Acetyl-CoA abgebaut werden, stellt er die Endstrecke ihres Abbaus dar.
- Der Citratzyklus liefert zudem die Ausgangssubstanzen für die Synthese einiger Aminosäuren. Aus Oxalacetat entsteht somit beispielsweise Aspartat, aus α-Ketoglutarat wird Glutamat und ausgehend von diesem können Glutamin, Prolin und Arginin synthetisiert werden.
- Das Reaktionsprodukt Citrat kann genauso gut abgezweigt werden und zur Synthese von Fettsäuren herangezogen werden.
- Kommt der Körper in eine Unterversorgung der Glucose (Glucosekonzentration im Blut zu niedrig), so kann das Oxalacetat ebenfalls abgezweigt werden und zur Synthese von Glucose verwendet werden.
- Ein anderes Reaktionsprodukt, das Succinyl-CoA, kann gemeinsam mit der Aminosäure Glycin zu δ-Aminolävulinsäure reagieren (Ausgangsstoff der Hämsynthese). Das allseits bekannte Häm besteht chemisch betrachtet aus einem sogenannten Porphyrinring, das zentral ein Eisen-Ion gebunden hat. Somit beginnt also die Biosynthese dieses Ringes ebenfalls im Citratzyklus.
Substratspezifität der Dehydrogenasen
Auf den ersten Blick erscheinen die Reaktionen bzw. deren Teilschritte des Citratzyklus recht unübersichtlich und kompliziert. Sie folgen jedoch durchaus einer biochemischen Logik, die man erkennen mann, wenn man berücksichtig, worin das eigentliche Ziel des Citratzyklus besteht und vor allem welche Reaktionsmechanismen dem menschlichen Stoffwechsel zur Verfügung stehen, um dieses Ziel zu erreichen.
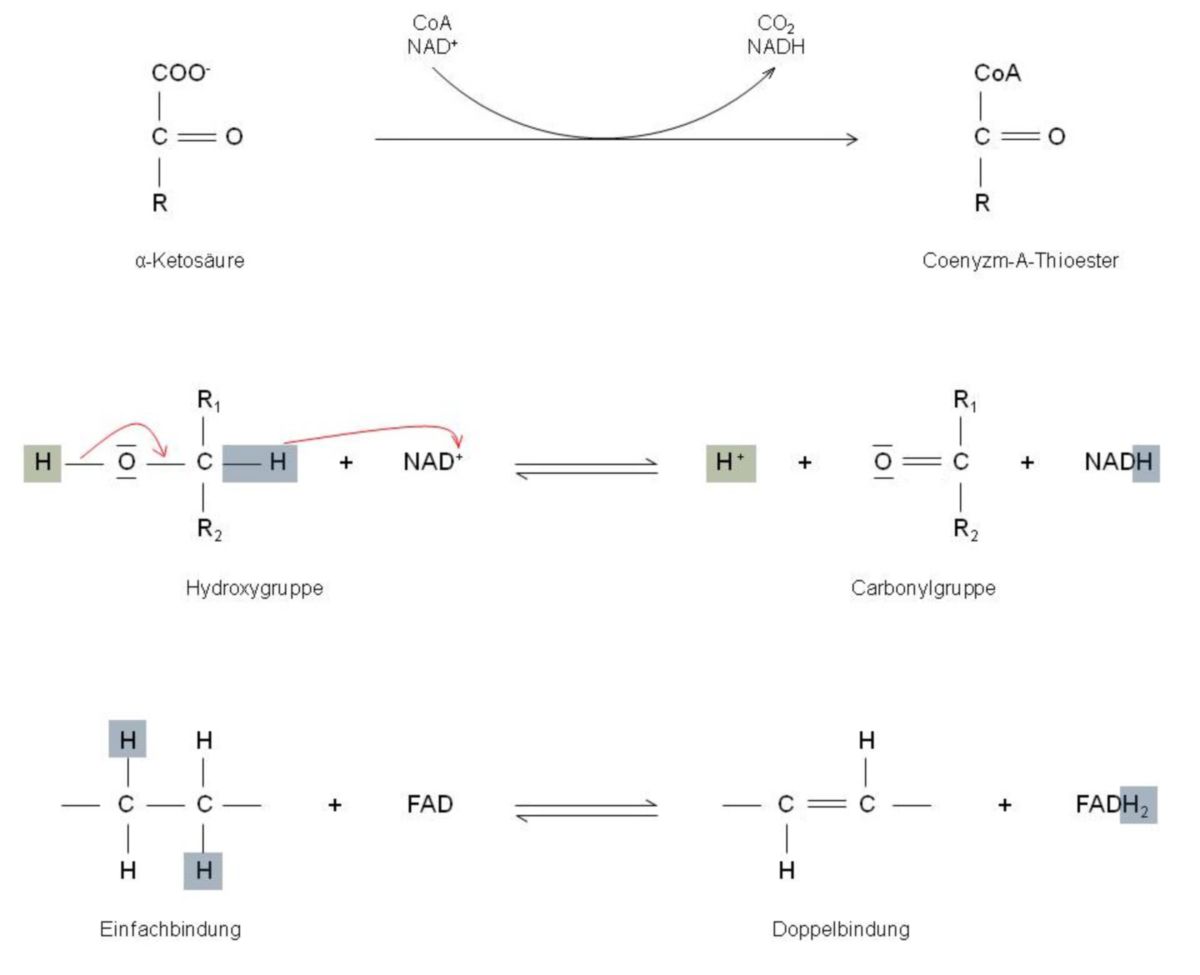
Vorab muss erwähnt werden, dass das primäre Ziel des gesamten Citratzyklus die Oxidation des Citrats ist. Um eine Oxidation vollziehen zu können, stehen dem Körper grundsätzlich verschiedene Dehydrogenasen zur Verfügung. Es handelt sich hierbei um Enzyme, die von ihren Substraten während einer Oxidation Elektronen ablösen um diese dann anschließend auf NAD+ oder auf FAD zu übertragen. Im Wesentlichen gibt es hier drei verschiedene Reaktionsmechanismen, die jeweils von Dehydrogenasen katalysiert werden können. Diese Katalysatoren bestimmen somit auch die einzelnen Schritte des gesamten Zyklus:
- Hier handelt es sich um die Pyruvat-Dehydrogenase (PDH), die eine α-Ketosäure erkennt, und zwar das Pyruvat. Sie erkennt es als Substrat und katalysiert somit eine vergleichsweise komplizierte Reaktionssequenz. Das Substrat wird dabei oxidiert und die Elektronen werden auf NAD+ übertragen, wobei die Carboxylgruppe in der Form von CO2 abgelöst und anschließend durch Coenzym A ersetzt wird. Somit kann man sagen, dass die PDH eine oxidative Decarboxylierung katalysiert. Im Stoffwechsel des Menschen kan eine derartige Reaktion nur für wenige Enzyme nachgewiesen werden.
- Im Gegensatz zur PDH katalysieren die meisten NAD+-abhängigen Dehydrogenasen wesentlich einfachere Reaktionen. Was sie aber immer gleich haben, ist, dass sie eine Übertragung eines Hydrid-Ions (H- ist ein Proton und zwei Elektronen) vermitteln - von einem Substrat auf einen Nicotinamidring des NAD+. In der Regel findet ein solcher Transfer aber nur dann statt, wenn das passende Substrat eine HO–C–H-Gruppe enthält. Das vorher erwähnte Hydrid-Ion (H-)entsteht aus dem H-Atom, gemeinsam mit den beiden Bindungselektronen aus der C-H-Gruppe. Somit geht es nicht aus der OH-Gruppe hervor. Da beim Herauslösen des Hydrid-Ions das C-Atom folglich einen Bindungspartner verliert, zieht es hierfür als Ersatz eines der Elektronenpaare der OH-Gruppe zu sich herüber. Die Folge davon ist, dass sich hier ein Proton (H+ ablöst und von der HO–C–H-Gruppe somit nur noch eine Carbonylgruppe (C=O) übrig bleibt.
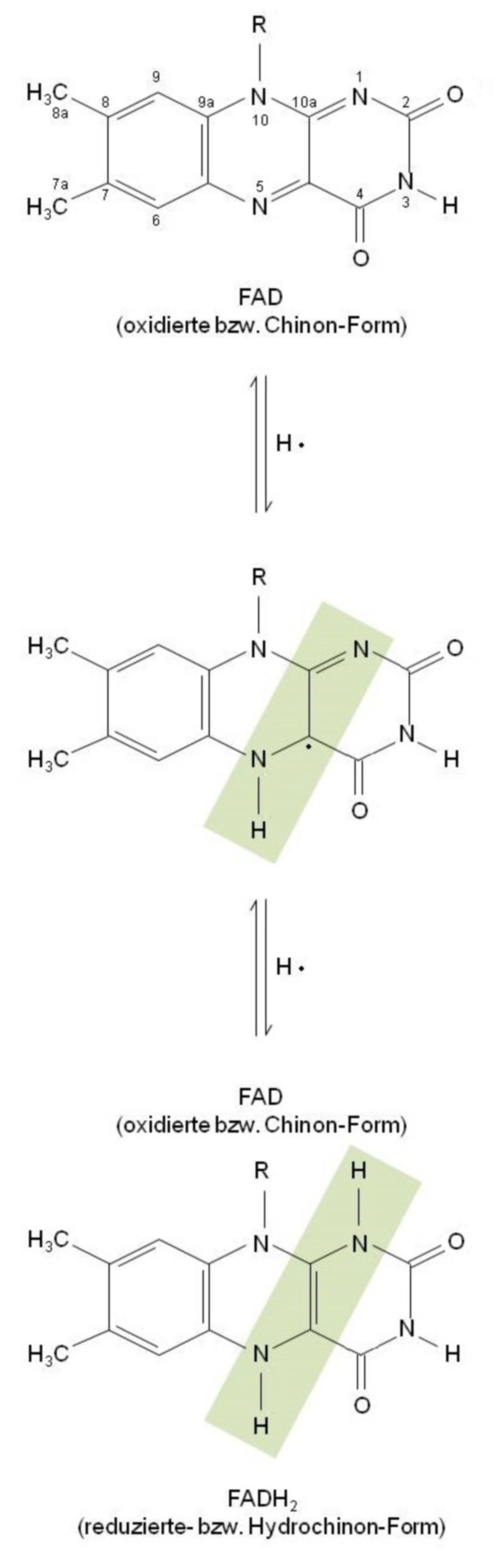
- Liegen FAD-abhängige Dehydrogenasen vor, so katalysieren diese die Übertragung von:
- 2 Elektronen und 2 Protonen oder,
- 1 Elektron und 1 Proton
auf ein FAD. Je nach dem, wie viele Elektronen bzw. Protonen übertragen werden, unterscheidet man beim FAD (gleich wie beim Ubichinon der Atmungskette) zwischen:
- oxidiertes Chinon,
- teilweise reduziertes Semichinon und
- vollständig reduziertes Hydrochinon (entspricht einem FADH2).
Bevorzugte Substrate von FAD-abhängigen Dehydrogenasen sind jene chemischen Gruppen, die vom Typ –CH2–CH2– sind. Grund dafür ist, dass sie diesen Gruppen durch das Abreißen von zwei Protonen und zwei Elektronen eine Doppelbindung verschaffen (–CH=CH–). Ungeeignet sind jedoch Substrate, die HO–C–H-Gruppen enthalten.
Somit sollte man sich merken, dass bei der Oxidation von Pyruvat, Citrat und Fettsäuren in den Mitochondrien nur drei Reaktionsmechanismen vorhanden sind:
- NAD+-abhängige Oxidation von den α-Ketosäuren
- NAD+-abhängige Oxidation von HO–C–H-Gruppen
- NAD+-abhängige Oxidation von –CH2–CH2-Gruppen
Einzelschritte
Um eventuelle Verwirrungen vorwegzunehmen, muss gesagt sein, dass die Zahl der Reaktionsschritte, die man im Laufe des Citronenzyklus unterscheidet, stark davon abhängt, in welchem Umfang man auch die Bildung instabiler Zwischenprodukte berücksichtigt. Dies ist auch der Grund, weshalb in verschiedenen Lehrbüchern unterschiedliche Anzahlen an Teilschritte angegeben sind. Beschränkt man sich jedoch nur auf die Bildung der wichtigsten stabilen Zwischenprodukte, so ergeben sich insgesamt 8 Reaktionsschritte.
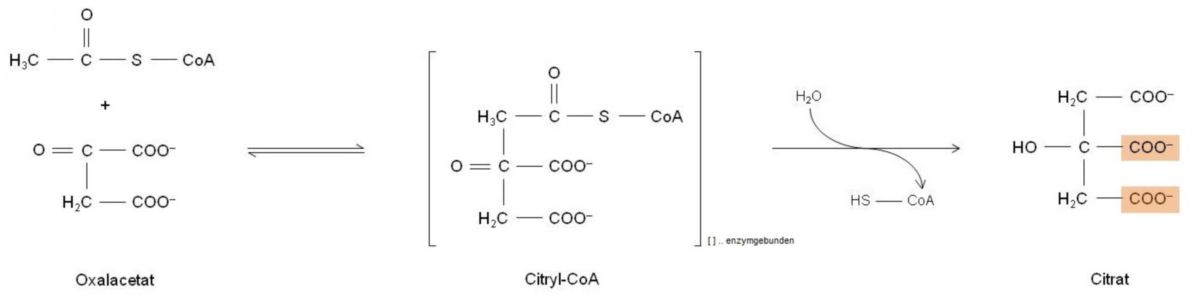
Schritt 1: Acetyl-CoA → Citrat
Im ersten Schritt wird der Carbonylkohlenstoff des Oxalacetats von der Methylgruppe des Acetyl-CoA angegriffen. Hierfür muss die Methylgruppe ein Proton abgeben, so kann sich eine neue C–C-Bindung ausbilden. Chemisch betrachtet erscheint diese Reaktion ungewöhnlich, da sich Methylgruppen an und für sich ausgesprochen reaktionsträge verhalten. Diese Reaktion ist endergon (es muss Energie zugeführt werden) und auch nur deshalb möglich, da anschließend die energiereiche Thioesterbindung des Acetyl-CoA hydrolisiert wird. Nun stellt sich die Frage, woher diese Energie genommen wird: Durch das Ablösen des Coenzyms A durch die Hydrolyse der Thioesterbindung wird Energie gelefiert, die letztlich die Triebkraft für die Bildung des Citrats ist. Die Reaktion wird vom Enzym Citrat-Synthase katalysiert.
Das hier gebildete Citrat ist das Anion der Zitronensäure (5 - 7 % in Zitronensaft auffindbar). Chemisch betrachtet ist Citrat ein symmetrisch aufgebautes Molekül, das insgesamt sechs C-Atome beinhaltet. Außerdem trägt es eine OH-Gruppe und insgesamt drei Carboxylgruppen und weist keine optische Aktivität auf. Grund hierfür ist das zentrale Kohlenstoffatom, welches mit zwei gleichen CH2–COO--Gruppen verbunden ist. Folgende Eigenschaft ist von grundlegender Bedeutung: Die vier Kohlenstoffbindungen weisen eine tetraedrische Struktur auf, wobei die OH-Gruppe und die COO--Gruppen des zentrealen C-Atoms zwei verschiedene Möglichkeiten besitzen, sich im Raum auszurichten. Das Citratmolekül weist somit eine Ober- und eine Unterseite auf - jedoch sind die Enzyme des Citratzyklus durchaus in der Lage, diese zu unterscheiden. Ein weiterer Vorteil der Enzyme ist, dass ihre Substrate jeweils nur in einer ganz bestimmten Konfiguration sich binden. Somit ist auch festgelegt, welche der drei Carboxylgruppen des Citrats in den darauffolgenden Schritten des Citratzyklus in Form von CO2 freigesetzt werden. Durch Nachforschen konnte nachgewiesen werden, dass beide CO2-Moleküle, die im Laufe eines Zyklus gebildet werden, ursprünglich aus dem Oxalacetat entstammen und eben nicht aus der neu aufgenommenen Acetylgruppe.
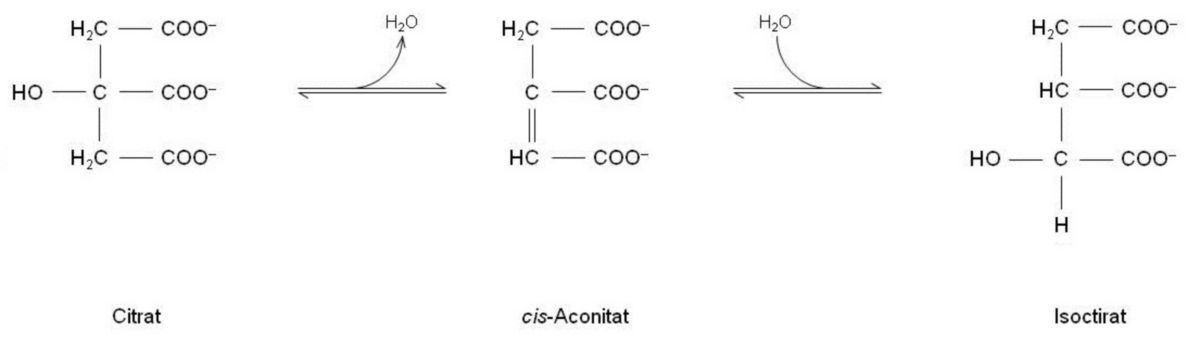
Schritt 2: Citrat → Isocitrat
Wie schon anfangs erwähnt wurde, soll das Citrat während des Zyklus oxidiert werden. Wir wissen aber, dass es weder eine HO–C–H- noch eine –CH2–CH2-Gruppe besitzt, weshalb es auch nicht als Substrat für NAD+- bzw. für FAD-abhängige Dehydrogenasen fungiert. Das Citrat muss also vorab in ein für Dehydrogenasen geeignetes Substrat umgewandelt werden, um weitere Schritte durchlaufen zu können. Indem die OH-Gruppe verschoben wird, wird dies möglich gemacht. Das daraus resultierende Isocitrat enthält die notwendige HO–C–H-Gruppe und ist somit auch ein geeignetes Substrat für eine NAD+-abhängige Dehydrogenase.
Diese in der Abbildung ablaufende Isomerisierung des Citrats zu Isocitrat erfolgt in zwei Schritten:
- Die OH-Gruppe des Citrats (links) wird gemeinsam mit einem Proton (H+) als Wasser (H2O) abgespalten, wodurch sich eine Doppelbindung bildet und aus dem ursprünglichen Citrat ein Aconitat entsteht. Die im Aconitat vorhandenen Carboxylgruppen (verbunden durch –C=C-Gruppe) weisen eine cis-Stellung auf (beide zur gleichen Seite hin orientiert). Dementsprecht spricht man hierbei von einem cis-Aconitat.
- Anschließend wird wieder ein Wasser angelagert - jedoch muss hier eine andere Anordnung stattfinden, damit schlussendlich Isocitrat hervorgeht.
Schritt 1 und 2 werden beide vom gleichen Enzym Aconitase (Aconitat-Hydratase) katalysiert.
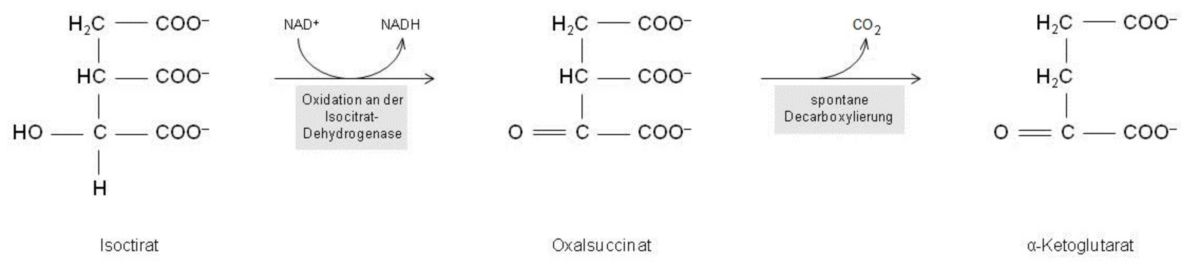
Schritt 3: Isocitrat → α-Ketoglutarat
In diesem Schritt ist eine NAD+-abhängige Oxidation der HO–C–H-Gruppe des Isocitrats notwendig, die von der Isocitrat-Dehydrogenase katalysiert und somit durchgeführt wird. Dieses Enzym ist dafür zuständig, dass ein Hydrid-Ion auf den Nicotinamidring des NAD+ übertragen wird. Parallel dazu kann man ein Ablösen eines Protons von der OH-Gruppe des Isocitrats beobachten, woraus eine Carbonylgruppe hervorgeht. Als Reaktionsprodukt erhält man Oxalsuccinat - eine instabile Verbindung, vond er sich spontan die mittlere der drei vorhandenen Carboxylgruppen als Kohlendioxid ablöst. Das α-Ketoglutarat bleibt dabei übrig, welches in neuer Nomenklatur auch gerne als 2-Oxoglutarat bezeichnet wird. Genauer betrachtet katalysiert also die Isocitrat-Dehydrogenase unmittelbar nur die Oxidation einer OH-Gruppe. Anschließend wird jedoch eine Decarboxylierung durchgeführt, die jedoch nicht von einem Enzym durchgeführt wird, sondern zufällig (aufgrund der Instabilität des Oxalsuccinats) abläuft.
Um nochmals einen kurzen Überblick über diesen Reaktionsablauf zu bekommen, werden folgenden Punkte aufgelistet:
- Das Enzym Isocitrat-Dehydrogenase ist für die Oxidationsreaktion des Citratzyklus zuständig. Es wird hierbei NADH gebildet - es werden also Elektronen für den Transport zur Atmungskette zur Verfügung gestellt.
- Die beschriebene Oxidationsreaktion hat zur Folge, dass die erste Decarboxylierung des Zyklus durchgeführt wird. Als Resultat entsteht hier CO2 (gleich dem Reaktionszyklus der PDH).
- Da als Reaktionsprodukt α-Ketoglutarat entsteht, kann dieses in einem einzigen weiteren Schritt (Aufnahme einer Aminogruppe in die Aminosäure Glutamat umgewandelt werden. Dieser Ablauf ist reversibel und ergibt eine wichtige Beziehung Beziehung zwischen Citratzyklus und Aminosäurestoffwechsel.
Reaktionsmechanismus:
Um den Ablauf dieses Reaktionsschrittes etwas genauer zu untersuchen, sollte man die Succinyl-CoA-Synthetase betrachten: Diese nimmt Succinyl-CoA auf und tauscht das CoA gegen ein anorganisches Phosphat aus, welches vorher aus der Umgebung aufgenommen wurde.
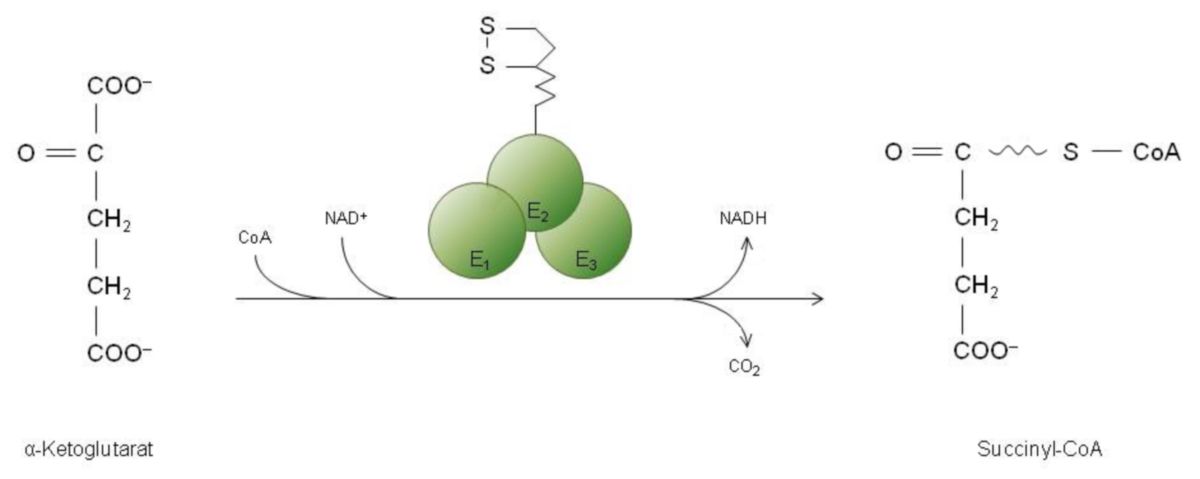
Schritt 4: α-Ketoglutarat → Succinyl-CoA
Vergleicht man α-Ketoglutarat mit Pyruvat, so erkennt man recht schnell, dass diese eine große Ähnlichkeit aufweisen. Außerdem gehören bei den α-Ketosäure an (bzw. 2-Oxosäuren). Genauer gesagt, sind sie Carbonsäuren, bei denen unmittelbar auf die Carboxylgruppe eine Carbonylgruppe aufzufinden ist. Es ist daher nicht überraschend, dass sich auch die dazugehörenden Enzyme, die mit diesen zwei Verbindungen reagieren, sich sehr ähnlich sein müssen. Man fand somit heraus, dass die α-Ketoglutarat-Dehydrogenase eine oxidative Decarboxylierung des α-Ketoglutarats katalysiert. Hier entspricht der Reaktionsmechanismus weitgehend dem Reaktionsmechanismus der Pyruvat-Dehydrogenase:
Somit sollte man sich merken, dass die Umsetzung von Pyruvat zu Acetyl-CoA durch die PDH und auch die Umsetzung von α-Ketoglutarat zu Succinyl-CoA eine oxidative Decarboxylierung mit den Cofaktoren ist:
- Thiaminpyrophosphat (TPP)
- Liponamid
- Coenzym A (CoA)
- FAD
- NAD+
Außerdem sollen die Einzelschrittel der oxidativen Decarboxylierung von α-Ketoglutarat noch erwähnt werden:
- Unter der Abspaltung von CO2 wird α-Ketoglutarat auf TPP übertragen.
- Das gerade entstandene Reaktionsprodukt wird von TPP auf Liponamid übertragen.
- Dadurch, dass das Reaktionsprodukt auf das Coenzym A übertragen wird, entsteht Succinyl-CoA.
- In diesen Schritten fallen zwei Elektronen an, die zunächst vom Liponamid aufgenommen werden, um anschließend - unter Vermittlung von FAD und NAD+ - abgegeben werden. Es wird hierbei NADH gebildet.
Aus diesem Reaktionsschritt sollte man sich somit merken, dass CO2 und NADH in folgenden Reaktionen des Citratzyklus entstehen:
- Isocitrat-Dehydrogenase,
- α-Ketoglutarat-Dehydrogenase (2-Oxoglutarat-Dehydrogenase).
Außerdem enstehen diese zwei Produkte auch in den Reaktionen der PDH. Die hier gebildeten CO2 (3 Reaktionen) stellen den Großteil des CO2 in der Ausatemluft dar.
Um erneut eine Verzweigung zum Stoffwechsel zu bilden, muss noch genauer auf Succinyl-CoA eingegangen werden. Dieses ist - ähnlich dem Acetyl-CoA - eine energiereiche Verbindung. Wie man wissen sollte, wird die Energie des Acetyl-CoA so genutzt, damit die Synthese des Citrats ermöglicht wird. Im Gegensatz dazu wird die Energie der Thioesterbindung des Succinyl-CoA im nächsten Schritt dazu verwendet, um GTP zu synthetisieren.
Das anfallende Succinly-CoA wird aber nur teilweise dem nächsten Schritt des Citratzyklus zur Verfügung gestellt. In den Mitochondrien kann das Succinyl-CoA auch mit der Aminosäure Glycin zu δ-Aminolävulinsäure reagieren - es ist der erste Metabolit der Hämsynthese. Das Häm bildet die prosthetische Gruppe des Hämoglobins und ist der Cytochrome der Atmungskette. Wie eingangs erwähnt wurde, stellt auch das Succinyl-CoA - gleich dem α-Ketoglutarat - eine wichtige Verzweigungsstelle des Stoffwechsels dar.
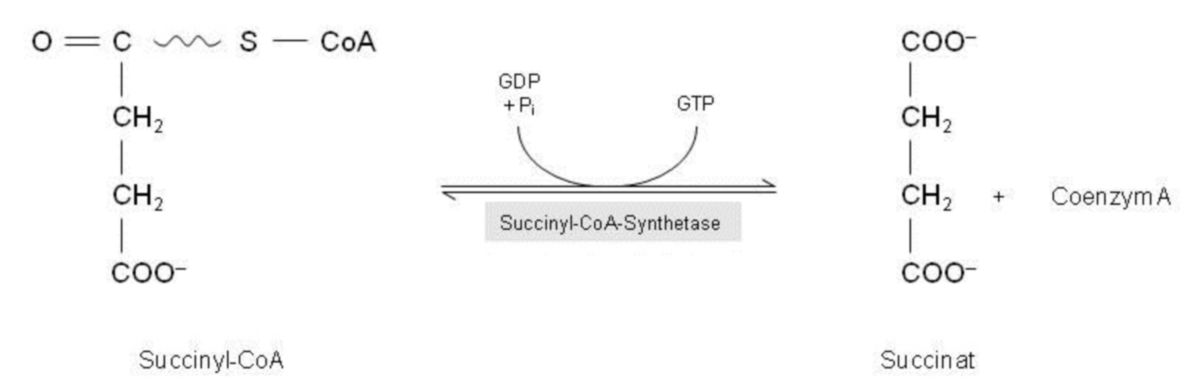
Schritt 5: Succinyl-CoA → Succinat + CoA + GTP
Im fünften Reaktionsschritt des Citratzyklus wird die energiereiche Thioesterbindung des Succinyl-CoA gespalten. Als Resultat des Zerfalls ensteht Succinat und freies Coenzym A. Ebenfalls wird bei der Spaltung der Bindung Energie frei, die ausreicht, um die Bildung von Guanosintriphosphat (GTP) aus GDP und anorganischem Phosphat zu ermöglichen. In der folgenden Reaktion kann dann die Energie des GTP dazu genutzt werden, um eine Phosphatgruppe des GTP auf ADP zu übertragen. Auf diese Weise wird ATP synthetisiert: GTP + ADP → GDP + ATP. Die hierfür notwendige Kinase, die als Katalysator für diesen Reaktionsmechanismus verantwortlich ist, wird nicht mehr zu den Enzymen des Citratzyklus gezählt.
Katalysiert wird dieser Vorgang von der Succinly-CoA-Synthetase (auch bezeichnet als Succinat-CoA-Ligase, Succinat-Thiokinase). Im Prinzip katalysiert dieses Enzym Reaktionen, die reversibel sind. Es ist dem Namen nach offensichtlich nach der Rückreaktion benannt worden. Der Unterschied zwischen "Synthase" und "Synthetase" liegt darin, dass bei der Reaktion einer Synthetase ein energiereiches Nukleotid beteiligt ist, und zwar das GTP.
Als Beispiel für eine Substratkettenphosphorylierung eignet sich die Bildung des GTP in der Reaktion der Succinyl-CoA-Synthetase. Als zweites wichtiges Beispiel einer Phosphorylierung dieser Art ist die Bildung von ATP in der Reaktion der 3-Phosphoglycerat-Kinase der Glykolyse: Während den Schritten vom [[Glycerinaldehyd-3-phosphat bis hin zum 3-Phosphoglycerat wird intermediär 1,3-Bisphosphoglycerat gebildet. Diese Verbindung übertrag eine seiner beidepn Phosphatgruppen auf das ADP, sodass schlussendlich 3-Phosphoglycerat und ATP resultiert.
Es muss noch erwähnt werden, dass in den Zellen durch Substratkettenphosphorylierung meist nur ein vergleichsweiser kleiner Anteil des ATP entsteht. Der weitaus größere Anteil des vorhandenen ATP wird von der mitochondrialen ATP-Synthase, also genauer gesagt durch die "oxidative Phosphorylierung" gebildet.
Reaktionsmechanismus:
Um den Verlauf dieses Reaktionsschrittes genauer verstehen zu können, muss man sich der Succinyl-CoA-Synthetase zuwenden: Diese nimmt das Succinyl-CoA auf und tauscht das darin vorhanden CoA gegen anorganisches Phosphat aus, welches es vorher aus der Umgebung aufgenommen hat. Somit entsteht aus dem Succinly-CoA zunächst einmal Succinly-Phosphat. Hier war also keine hydrolytische, sondern eine phosphorolytische Spaltung "am Werk". Anschließend wird die Phosphat-Gruppe erst einmal auf ein Histidin des Enzyms, anschließend von hier auf ein GDP übertragen, sodass GTP entsteht.
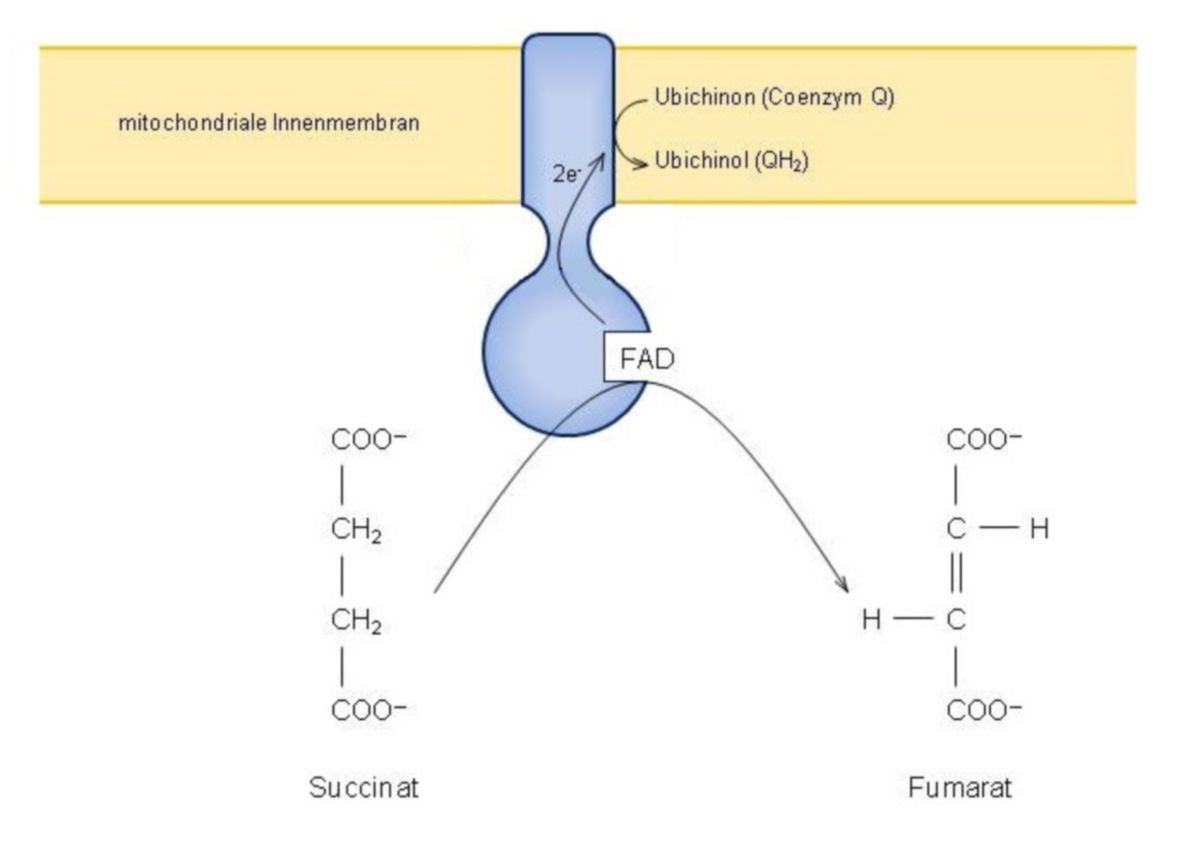
Schritt 6: Succinat → Fumarat + FADH2
Aufgrund der vorausgehenden Reaktion ist mit dem Succinat eine - chemisch betrachtet - sehr einfache Verbindung entstanden: eine Dicarbonsäure. Hier sind zwei Carboxylgruppen durch zwei CH2-Gruppen verbunden. Succinat kennt man auch als das Anion der Bernsteinsäure.
Succinat erweist sich deshalb als ein geeignetes Substrat für die FAD-abhängige Succinat-Dehydrogenase da es eine −CH2−CH2-Gruppe besitzt. Wird es oxidiert, so entsteht FADH2 und zusätzlich bildet sich im Succinat eine Doppelbindung. Als Reaktionsprodukt erhält man Fumarat - es ist das Anion der Fumarsäure.
Somit sollte man sich folgende zwei Punkte merken:
- FAD bzw. FADH2 ist als sogenannte prosthetische Gruppe kovalent mit der Succinat-Dehydrogenase verbunden. Man zählt das Enzym somit zu den Flavoproteinen.
- Die Succinat-Dehydrogenase ist - im Gegensatz zu den anderen Enzymen, die im Citratzyklus als Katalysatoren wirken und sich frei in der mitochondrialen Matrix bewegen - in der mitochondrialen Innenmembran verankert. Dies ist auch der Grund, weshalb sie ihre FADH2-gebundenen Elektronen direkt in die Atmungskette einspeisen kann. Sie wird deshalb auch als Komplex II der Atmungskette bezeichnet.
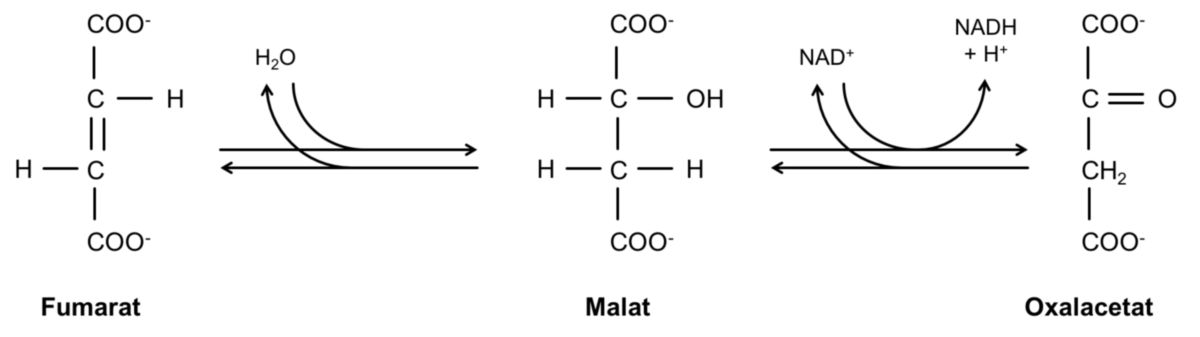
Schritt 7: Fumarat + Wasser → Malat
Biochemisch gesehen ist Fumarat als Substrat für eine Dehydrogenase ungeeignet. Lagert man jedoch Wasser an, so ensteht ein Substrat - das Malat - das für eine NAD+-abhängige Dehydrogenase geeignet ist. Malat kennt man auch als das Anion der Apfelsäure (lat. malum = Übel, Apfel). Dieser Reaktionsschritt (Reaktion des Fumarats mit Wasser) wird von der Fumarat-Hydratase katalysiert.
Betrachtet man diese Reaktion etwas genauer, so fällt eine Ähnlichkeit mit der Bildung des Isocitrats aus Aconitat auf. Das Isocitrat ensteht ebenfalls durch eine Anlagerung von Wasser - hier aber an eine Doppelbindung. In beiden Fällen jedoch ensteht eine Verbindung, die eine HO–C–H-Gruppe enthält und somit als Substrat für eine NAD+-abhängige Dehydrogenase geeignet ist.
Schritt 8: Malat → Oxalacetat
Im letzten Teilschritt des Citratzyklus wird die HO–C–H-Gruppe des Malats NAD+-abhängig von der Malat-Dehydrogenase zu einer Carbonylgruppe oxidiert. Als Reaktionsprodukt erhält man Oxalacetat, wleches durch die Reaktion mit Acetyl-CoA wiederum eine neue Runde des Citratzyklus eröffnen kann.
Es sollte unbedingt erwähnt werden, dass die Oxidation des Malats zu Oxalacetat ein eindrucksvolles Beispiel für Reaktionen in der Biochemie ist, da hier das chemische Gleichgewicht unter Standardbedingungen ganz auf der Seite der Edukte (!) liegt - ΔG ist also positiv. Dies mag erstmals ungewöhnlich erscheinen - aber die Reaktion läuft nur deshalb in einem nennenswerten Umfang ab, da das gebildete Oxalacetat in den Mitochondrien schnell mit Acetyl-CoA reagiert und somit dem Gleichgewicht entzogen wird. Unter physiologischen Bedingungen ist deshalb das ΔG negativ (gleich wie bei der Isomerisierung von Glucose-6-phosphat zu Fructose-6-phosphat im Rahmen der Glykolyse). Die Triebkraft der Reaktion wird somit wesentlich durch die Konzentrationsverhältnisse der Reaktionspartner gesteuert.
Außerdem sind das Malat und Oxalacetat nicht nur Metabolite des Citratzyklus, sie fungieren auch als Ausgangsstoffe in der Gluconeogenese, also dem Stoffwechselweg, in dem in der Leber bei Bedarf Glucose synthetisiert wird. Oxalacetat wird dazu in erheblichem Umfang teils in Malat, teils in die Aminosäure Aspartat umgewandelt. Diese zwei Produkte werden dann aus den Mitochondrien in das Zytosol exportiert. In der Gluconeogenese läuft dieser Schritt also in umgekehrter Richtung ab. Der Unterschied jedoch ist, dass es für die Gluconeogenese durchaus vorteilhaft ist, dass das Gleichgewicht der Reaktion auf der Seite des Malats liegt.
Übersicht
Wie man aus der Abbildung des Zyklus erkennen kann, sind mehrere der eingezeichneten Reaktionen des Citratzyklus reversibel. Dies gilt also für die Isomerisierung des Citrats zu Isocitrat (Katalysator: Aconitase), aber auch besonders für die letzten vier Schritte: Succinyl-CoA → Oxalacetat. Dieser Abscnitt des Citratzyklus beinhaltet eine wichtige Tatsache: die Reversibilität der Reaktion der Malat-Dehydrognase - diese ist nämlich eine wichtige Voraussetzung der Gluconeogenese. Es stellt sich nun die Frage, weshalb die übrigen Reaktionen irreversibel sind:
- Da jeweils in den Reaktionen der Isocitrat-Dehydrogenase und auch der α-Ketoglutarat-Dehydrognase CO2 freigesetzt wird, müsste dieses in einer Rückreaktion durch das Aufwenden von Energie der Substrate carboxyliert werden.
- Da in der Reaktion der Citratsynthase die energiereiche Thioesterbindung im Acetyl-CoA gespalten wird, kann dieser Schritt nicht wieder so leicht rückgängig gemacht werden.
Außerdem muss noch erwähnt werden, dass bei der Substratkettenphosphorylierung - ausgehend von Succinyl-CoA - ebenfalls eine energiereiche Thioesterbindung gespalten wird. Die hier freiwerdende Energie wird jedoch zu einem großen Teil im GTP gespeichert. Somit gilt: ist genügend GTP und Succinat in einer Zelle (in hoher Konzentration) vorhanden, so kann die Reaktion auch in umgekehrter Richtung ablaufen.
Quellen
- Duale Reihe "Biochemie", Joachim Rassow et. al., 3. Auflage, Georg Thieme Verlag
- Zeeck "Chemie für Mediziner", A. Zeeck et. al., 7. Auflage, Urban & Fischer Verlag
- "Chemie", Charles E. Mortimer, Ulrich Müller, 10. Auflage, Georg Thieme Verlag