Glykolyse
von altgriechisch: γλυκύς ("glykys") - süß und λύσις ("lysis") - Auflösung'
Synonyme: Embden-Meyerhof-Parnas-Weg, EMP-Weg
Englisch: glycolysis
Definition
Die Glykolyse ist der erste Teil des Glukosestoffwechsels und kommt universal bei Prokaryoten und Eukaryoten vor. Sie ist ein biochemischer Abbauweg, der in mehreren Schritten ein Molekül Glucose in zwei Moleküle Pyruvat umwandelt.
Hintergrund
Die Glykolyse ist der einzige metabolische Weg, den praktisch alle Organismen gemein haben, was auf eine sehr frühe Entstehung hinweist. Diese fand vermutlich in den ersten Prokaryoten vor 3,5 Milliarden Jahren statt.
Die Glykolyse spielt eine zentrale Rolle im Zellstoffwechsel. Sämtliche Kohlenhydrate bzw. deren Abbauprodukte gehen an verschiedenen Stellen in diesen katabolischen Stoffwechselweg ein.
Die Glykolyse findet im Zytosol der Zelle sowohl unter anaeroben, als auch aeroben Bedingungen statt. Dabei wird Glucose schrittweise zu Pyruvat abgebaut. In anaeroben Organismen und überwiegend anaerob arbeitenden Zellen oder Geweben wird Pyruvat weiter zu Milchsäure (bei Hefe Ethanol) verstoffwechselt. Aerob arbeitende Organismen und Gewebe bauen Pyruvat im Citratzyklus und der anschließenden Atmungskette weiter zu CO2 ab. Darüber entsteht der Großteil an Reduktionsäquivalenten und ATP (oxidative Phosphorylierung).
Überblick
Die Glykolyse kann grob in zwei Abschnitte unterteilt werden:
- Der erste Abschnitt dient quasi der "Vorbereitung". Es finden noch keine Prozesse statt, die der Zelle unmittelbar nutzen. Im Gegenteil: Die Zelle wendet zunächst ATP auf, um die Glucose so zu modifizieren, dass Glycerinaldehyd-3-phosphat entsteht, das für den zweiten und entscheidenden Abschnitt der Glykolyse geeignet ist.
- Abschnitt 2 beinhaltet den Abbau von Glycerinaldehyd-3-phosphat in mehreren Schritten zu Pyruvat. Im Gegensatz zum ersten Abschnitt werden jetzt ATP - und zwar doppelt so viel wie im ersten Abschnitt verbraucht worden ist - und NADH gewonnen.
Teilschritte
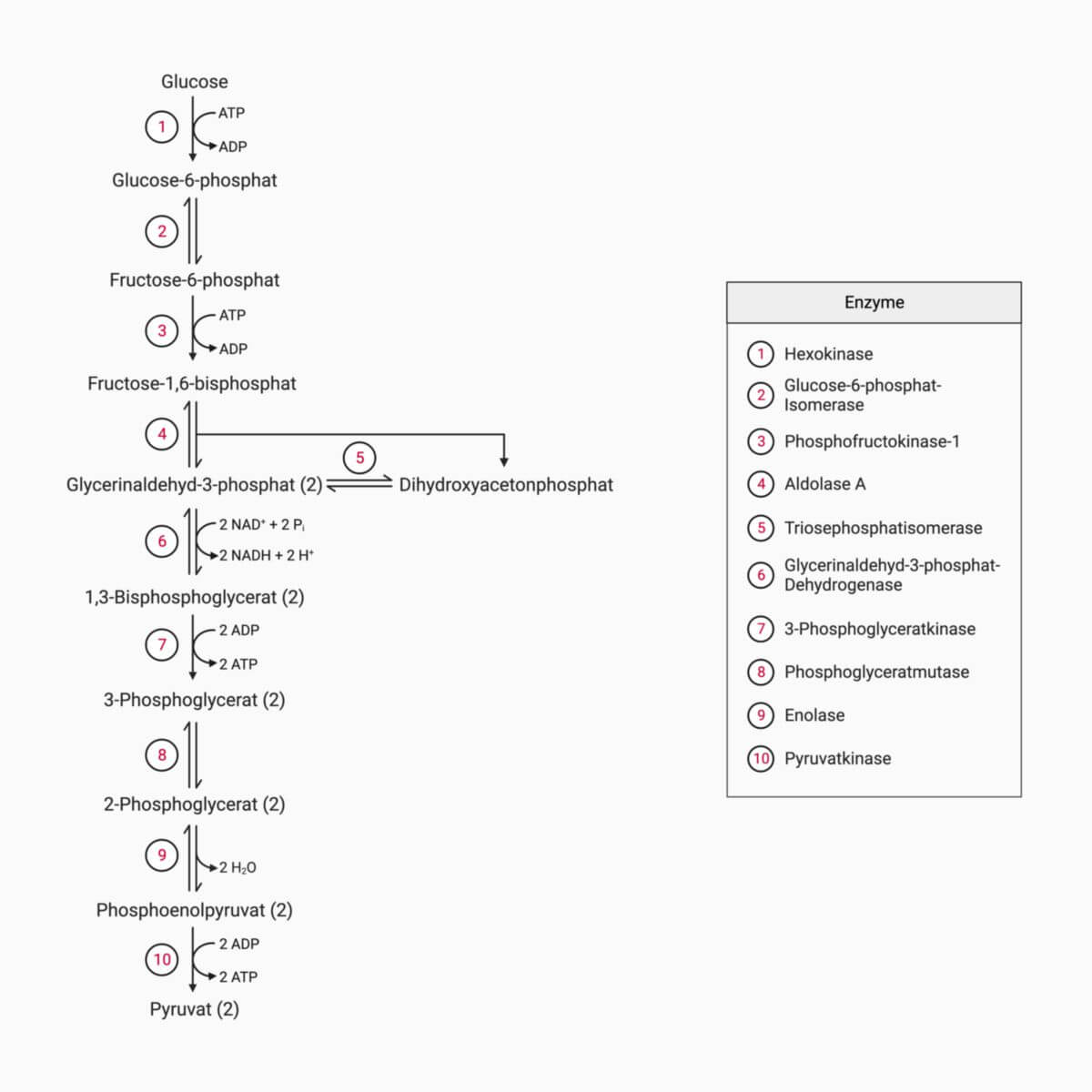
Die Glykolyse gliedert sich in zehn Teilschritte, von denen jeder durch ein bestimmtes Enzym katalysiert wird.
Erster Abschnitt der Glykolyse
In diesem Abschnitt entsteht aus Glukose (C6H12O6) zunächst in drei Schritten Fructose-1,6-bisphosphat. Diese beinhalten zwei ATP-abhängige Phosphorylierungen und eine Isomerisierung. Unter der Einwirkung der Aldolase A zerfällt final Fructose-1,6-bisphosphat in Dihydroxyacetonphosphat und Glycerinaldehyd-3-phosphat.
Schritt 1: Glucose → Glucose-6-phosphat
Sogenannte GLUT-Proteine (Glucosetransporter) ermöglichen eine Diffusion der Glucose sowohl in die Zellen hinein als auch heraus. Das Molekül (C6H12O6) folgt dabei ausschließlich dem Konzentrationsgefälle. Wird es intrazellulär schnell zu Glucose-6-phosphat phosphoryliert (siehe Abbildung), wird es dem Gleichgewicht entzogen. Das für die Phosporylierung benötigte Phosphat liefert ATP. In den meisten Zellen des Körpers wird diese Reaktion durch das Enzym Hexokinase katalysiert. Die Reaktion sorgt damit für die Aufrechterhaltung des Konzentrationsgefälles, sodass weiterhin Glucose einströmt.
Glucose-6-phosphat weist einen höheren Energiegehalt auf als Glucose. Das heißt, dass das ΔG (Gibbs-Energie) der Phosphorylierung der Glucose positiv ist, worauf die Reaktion auch in Gegenwart eines geeigneten Enzyms wie der Hexokinase nicht von alleine ablaufen kann. Die biochemische Reaktion ist nur durch eine energetische Kopplung möglich. Erst nachdem die Kopplung mit der Spaltung einer Anhydridbindung im Triphosphat des ATP erfolgt, ist das ΔG der Gesamtreaktion negativ und die gekoppelte Reaktion damit thermodynamisch möglich.
Das Enzym Hexokinase weist eine hohe Affinität gegenüber der Glucose auf (niedriger Km-Wert). In den Hepatozyten und den B-Zellen des Pankreas wird Glucose von einem Isoenzym der Hexokinase, der Glucokinase, katalysiert. Dieses weist eine rund 50fach niedrigere Affinität zur Glucose auf (hoher Km-Wert). Das führt dazu, dass die Leberzellen vorwiegend die Glucose aufnehmen, die nach einer Nahrungsaufnahme als Überschuss vorliegt. Diese wird dann in Form von Glykogen gespeichert. Die B-Zellen des Pankreas die Möglichkeit, auf außerordentlich hohe Glucosekonzentrationen zu reagieren und sezernieren daraufhin Insulin, auch weil die Glucokinase nicht über eine Feedback-Hemmung inhibiert wird.
Schritt 2: Glucose-6-phosphat → Fructose-6-phosphat
In Schritt 2 der Glykolyse wird Glucose-6-phosphat zu Fructose-6-phosphat isomerisiert. Unter Standardbedingungen liegt das Gleichgewicht der Reaktion auf der Seite des Glucose-6-phosphats. Da das Fructose-6-phosphat in der Zelle schnell weiterverwertet wird, kann die Isomerisierung in Richtung des Fructose-6-phosphats ablaufen. Der Reaktionsschritt wird durch das Enzym Glucose-6-phosphat-Isomerase katalysiert.
Darüber hinaus wird Glucose-6-Phosphat bei Energieüberschuss auch für die Glykogensynthese verwendet und liefert im Pentosephosphatweg NADPH und Ribulose-5-phosphat zur Bildung von Pentosephosphat.
Schritt 3: Fructose-6-phosphat → Fructose-1,6-bisphosphat
Fructose-6-phosphat wird durch die Phosphofructokinase-1 (PFK-1) zu Fructose-1,6-bisphosphat (F-1,6BP) phosphoryliert. Auch dabei wird ein ATP wird aufgewendet. Dadurch ist dieser Schritt der Glykolyse irreversibel. Das Enzym Phosphopfructokinase-1 gilt als das Schlüsselenzym der Glykolyse, da es den geschwindigkeitsbestimmenden Schritt katalysiert. Die katalytische Aktivität dieses Enzyms kann sehr unterschiedlich sein - sie hängt von den Gegebenheiten des Stoffwechsels ab. Einer der wichtigsten Aktivatoren dieses Reaktionsschrittes ist Fructose-2,6-bisphosphat. F-2,6BP ist ein Derivat von Fructose-6-phosphat und wird im Zytosol durch die Phosphofructokinase-2 (PFK-2) mittels ATP-abhängiger Phosphorylierung auf einem Nebenweg der Glykolyse synthetisiert. Es beschleunigt die Reaktion der Phosphofructokinase-1.
Schritt 4: Fructose-1,6-bisphosphat → Glycerinaldehyd-3-phosphat + Dihydroxyacetonphosphat
Dieser Reaktionsschritt beinhaltet die Spaltung der Hexose Fructose-1,6-bisphosphat in die zwei Triosen Glycerinaldehyd-3-phosphat und Dihydroxyacetonphosphat. Da die Reaktion eine sogenannte Aldolspaltung ist, wird sie vom Enzym Aldolase A katalysiert.
Schritt 5: Dihydroxyacetonphosphat → Glycerinaldehyd-3-phosphat
Glycerinaldehyd-3-phosphat und Dihydroxyacetonphosphat können ineinander umgewandelt werden. In den 2. Abschnitt der Glykolyse kann nur Glycerinaldehyd-3-phosphat eingespeist werden, deshalb läuft die Isomerisierung in Richtung Glycerinaldehyd-3-phosphat ab. Das Enzym, das diese Umwandlung katalysiert, ist die Triosephosphatisomerase.
Zweiter Abschnitt der Glykolyse
Im 2. Abschnitt wird Glycerinaldehyd-3-phosphat zu 3-Phosphoglycerat oxidiert und anschließend zu Pyruvat abgebaut. Bei der Oxidation wird Energie freigesetzt, die zur Bildung von ATP und NADH führt - doppelt so viel ATP wie im ersten Abschnitt verbraucht wurde.
Schritt 6: Glycerinaldehyd-3-phosphat → 1,3-Bisphosphoglycerat
Im sechsten Schritt der Glykolyse bindet Glycerinaldehyd-3-phosphat kovalent an das Enzym Glycerinaldehyd-3-phosphat-Dehydrogenase (GAPDH). Folgende Prozesse laufen nacheinander ab:
- Oxidation des Glycerinaldehyd-3-phosphats
- Phosphorolytische Freisetzung des Reaktionsprodukts unter Aufnahme von anorganischem Phosphat
Das Enzym Glycerinaldehyd-3-phosphat-Dehydrogenase bindet Glycerinaldehyd-3-phosphat und NAD+. Der Carbonylkohlenstoff des Glycerinaldehyd-3-phosphats wird auf das Schwefelatom einer SH-Gruppe des Enzyms übertragen. Als Resultat dieser Übertragung entsteht aus der Carbonylgruppe eine H-C-OH-Gruppe. Die Reaktion der Aldehydgruppe des Glycerinaldehyd-3-phosphats mit der SH-Gruppe erinnert an die Ringbildung der Kohlenhydrate: Da in der Glucose die Aldehydgruppe des Kohlenstoffatoms Nr. 1 mit der OH-Gruppe des Kohlenstoffatoms Nr. 5 reagiert, steht ein Halbacetal. Da der Schwefel im Periodensystem der Elemente direkt unter dem Sauerstoff steht, ähneln SH-Gruppen in ihren chemischen Eigenschaften den OH-Gruppen. Deshalb bezeichnet man das Zwischenprodukt im Reaktionsmechanismus der Glycerinaldehyd-3-phosphat-Dehydrogenase in Analogie zum Halbacetal der Kohlenhydrate als Thiohalbacetal.
Anschließend nimmt das NAD+ des Enzyms ein Hydrid-Ion von der oben entstandenen H-C-OH-Gruppe auf, wodurch wieder eine Carbonylgruppe entsteht.
Indem die OH-Gruppe ein Proton abgibt und der Sauerstoff gleichzeitig eine weitere Bindung zum Kohlenstoff ausbildet, werden die vier Bindungen des Substrat-Kohlenstoffatoms wiederhergestellt. Somit geht die H-C-OH-Gruppe wieder in ihren Ursprungszustand über – eine Carbonylgruppe. Das NADH-Molekül löst sich gemeinsam mit dem von der OH-Gruppe abgespaltenen Proton als NADH + H+ vom Enzym ab.
Es liegt nun kein Thiohalbacetal mehr vor, sondern ein Thioester. Die Aldehydgruppe des Glycerinaldehyd-3-phosphats wird unter Reduktion von NAD⁺ zu NADH zu einer Thioester-gebundenen Carboxylgruppe oxidiert.
Die Oxidation ist thermodynamisch begünstigt, wobei die frei werdende Energie zunächst im Thioester und anschließend in der Acylphosphatbindung konserviert wird. Daraus resultiert, dass die Phosphatgruppe am 1. Kohlenstoffatom ein hohes Gruppenübertragungspotenzial besitzt.
Schritt 7: 1,3-Bisphosphoglycerat → 3-Phosphoglycerat
Das hohe Gruppenübertragungspotenzial des 1,3-Bisphosphoglycerat spielt eine wichtige Rolle in der folgenden Substratkettenphosphorylierung und der Übertragung der Phosphatgruppe der Position 1 auf das ADP. Durch diese Gruppenübertragung wird ein ATP gebildet, wobei 3-Phosphoglycerat als Rest anfällt. Damit ist die Energiebilanz der bisherigen Glykolyse ausgeglichen. Katalysiert wird der Reaktionsschritt von der 3-Phosphoglyceratkinase.
Die entscheidende energieliefernde Reaktion der gesamten Glykolyse ist damit die Reaktion der Phosphoglyceratkinase.
Falls die Zelle bereits viel ATP (und damit wenig ADP) hat, hält die Reaktion an dieser Stelle an, bis wieder genügend ADP zur Verfügung steht. Dieser Regelkreis ist wichtig, da ATP relativ schnell zerfällt, wenn es nicht genutzt wird. Eine Überproduktion von ATP wird somit verhindert.
Bei der Glykolyse der Erythrozyten gibt es in diesem Schritt eine Besonderheit, einen möglichen "Umweg" über das 2,3-Bisphosphoglycerat. Bei unzureichender Sauerstoffversorgung des Gewebes wird die energiereiche Säureanhydridbindung des 1,3-Bisphosphoglycerats in eine energieärmere Esterbindung umgewandelt. Es entsteht das Zwischenprodukt 2,3-Bisphosphoglycerat. Letzteres kann allosterisch an die Desoxy-Form des Hämoglobin-Moleküls (ß-Kette) binden und setzt so die Sauerstoffaffinität herab. Das Hämoglobin gibt Sauerstoff bereitwilliger ab (Rechtsverschiebung der Sauerstoffbindungskurve). Der Energiegehalt von 2,3-Bisphosphoglycerat reicht jedoch nicht mehr aus, um bei der Reaktion zu 3-Phosphoglycerat (katalysiert durch 2,3-Bisphosphoglycerat-Phosphatase) ein ATP zu bilden. Die Energiebilanz bei unzureichender Sauerstoffbilanz beträgt dann nur ein ATP.
Schritt 8: 3-Phosphoglycerat → 2-Phosphoglycerat
In diesem kurzen Zwischenschritt wird das 3-Phosphoglycerat zu 2-Phosphoglycerat isomerisiert. Es findet eine Verschiebung der Phosphatgruppe statt, die von einer Isomerasen katalysiert wird, der Phosphoglyceratmutase.
Schritt 9: 2-Phosphoglycerat → Phosphoenolpyruvat
Anschließend wird eine Abspaltung von H2O von der Enolase katalysiert, was zur Bildung von Phosphoenolpyruvat (PEP) führt. Diese Dehydratisierung geht mit einer Umverteilung der Energie innerhalb des Moleküls einher, wobei die Phosphatgruppe der Position 2 ein hohes Gruppenübertragungspotenzial erhält.
Schritt 10: Phosphoenolpyruvat → Pyruvat
Der zehnte und letzte Schritt der Glykolyse besteht aus der Übertragung der Phosphatgruppe des Phosphoenolpyruvats auf ein ADP-Molekül, wodurch ein weiteres Molekül ATP entsteht. Als Nebenprodukt entsteht Pyruvat (Anion der Brenztraubensäure). Die im Phosphoenolpyruvat enthaltene Phosphatgruppe wurde ursprünglich nicht als anorganisches Phosphat gebunden, sondern wurde unter Verbrauch von ATP im ersten Abschnitt der Glykolyse aufgenommen. Dadurch wird in diesem Schritt rechnerisch das ATP regeneriert, das im 1. Abschnitt der Glykolyse verbraucht wurde.
Das Enzym, das diese irreversible, geschwindigkeitsbestimmende Reaktion ermöglicht, ist die Pyruvatkinase.
Energiebilanz
Da in der Glykolyse von einem Molekül Glucose ausgegangen wird, werden daraus zwei Moleküle Glycerinaldehyd-3-phosphat abgebaut. Somit ergibt die Glykolyse netto 2 ATP und 2 NADH: 4 ATP werden zwar gewonnen, jedoch müssen im Verlauf der Reaktionsschritte 2 ATP wieder aufgewendet werden.
Bemerkenswert ist, dass die meisten Reaktionen, die der Bildung von Fruktose-1,6-bisphosphat folgen, energetisch ungünstig sind. Sie würden kaum ablaufen, wenn sie nicht durch die energetisch günstigen Kinasereaktionen (Phosphofructokinase), Phosphoglyceratkinase, Pyruvatkinase)) "hindurchgezogen" werden würden. Die hier zugrundeliegende Strategie ist erwähnenswert, begünstigt diese Gleichgewichtslage doch die Glukoneogenese - die Synthese von Glucose aus Pyruvat bei günstigem Energiestatus. Dies erfordert alle Enzyme, bis auf zwei der erwähnten "Zugpferde", die allein der Glykolyse zugeordnet und hier mit -14 und -24 kJ/mol stark exergon sind.
Prokaryonten bringt die Glykolyse 2 Moleküle ATP pro Molekül Glukose. Die Mitochondrien eines Eukaryonten können aus den beiden Pyruvat-Molekülen durch die Pyruvatdehydrogenase, den Citratzyklus und die Atmungskette insgesamt 34 Moleküle ATP gewinnen.
Die Glykolysereaktionen bis zum Pyruvat werden sowohl in aerob als auch in anaerob arbeitenden Geweben durchlaufen. Die Regeneration des Oxidationsmittels NAD+, das zur Oxidation des Glyzerinaldehyd-3-phosphats durch die zugeordnete Dehydrogenase GAPDH eingesetzt und dabei zu NADH+H+ reduziert wird, erfolgt im ersten Fall in der Atmungskette. Im Falle anaeroben Stoffwechsels ist hierfür die stark exergone (ΔGo´ = - 25 kJ/mol) Lactatdehydrogenase (LDH) zuständig: Reduktion von Pyruvat mit NADH+H+ liefert Lactat und regeneriert NAD+ (bei Hefe wird diese Funktion durch zwei Enzyme, Pyruvatdecarboxylase plus Alkoholdehydrogenase übernommen).
Klinik
Labormedizin
Eine fortlaufende Glykolyse kann in gelagerten Blutproben zu falschen Glukose- und Laktatwerten führen. Deshalb werden Blutröhrchen verschiedene Inhibitoren zugesetzt, u.a. Natriumfluorid (NaF).
Zahnmedizin
Bakterien in der Plaque produzieren mithilfe der anaeroben Glykolyse Laktat, das den Zahnschmelz demineralisiert.
Lerntipp
Um das Erlernen der Glykolyse zu erleichtern, kann man sich zuerst die Namen der Metaboliten einprägen und erst im zweiten Schritt mit den funktionellen Aspekten der Glykolyse beschäftigen.
'