Atmungskette
Synonyme: respiratorische Kette, Elektronentransportkette
Englisch: respiratory chain, electron transport chain
Definition
Die Atmungskette ist eine Abfolge von Redoxreaktionen an der inneren Mitochondrienmembran, über die Elektronen aus den Reduktionsäquivalenten NADH und FADH2 schrittweise auf molekularen Sauerstoff (O2) übertragen werden. In aeroben Zellen ist O2 der terminale Elektronenakzeptor.
Funktion
Die Atmungskette ist der zentrale Prozess der zellulären Energiegewinnung. Die bei den Reaktionen frei werdende Energie wird genutzt, um Protonen (H+) aus dem Matrixraum in den Intermembranraum der Mitochondrien zu transportieren. Dadurch entsteht ein elektrochemischer Protonengradient (protonenmotorische Kraft), der die ATP-Synthase antreibt und zur Bildung von ATP führt (oxidative Phosphorylierung).
Bestandteile
Elektronendonoren
Die Elektronen stammen hauptsächlich aus den Reduktionsäquivalenten:
- NADH (v.a. aus Glykolyse, Citratzyklus und β-Oxidation)
- FADH2 (u.a. aus dem Citratzyklus und der β-Oxidation)
Mobile Elektronenüberträger
Neben den großen Membrankomplexen sind zwei mobile Überträger zentral:
- Ubichinon (Coenzym Q): lipophiler Elektronen- und Protonenträger innerhalb der Membran (oxidiert: Q, reduziert: QH2)
- Cytochrom c: lösliches Elektronenträgerprotein im Intermembranraum, transportiert jeweils ein Elektron von Komplex III zu Komplex IV
Cytochrome sind Häm-haltige Elektronenträgerproteine und keine Enzyme im engeren Sinn. Sie sind rot gefärbt und ähneln in ihrer Struktur dem sauerstoffübertragenden Hämoglobin in den Erythrozyten. In jedem Cytochrom-Molekül kann das Eisen in seiner zweiwertigen Form (Ferro-Form, Fe2+) oder in der dreiwertigen Form (Ferri-Form, Fe3+) existieren. So kann das Cytochrom-Molekül in seiner Fe3+-Form durch Aufnahme eines Elektrons in den reduzierten Zustand Fe2+ überführt werden. Im reduzierten Zustand kann es das Elektron an den nächsten Überträger weitergeben und so fort. Nur das letzte Cytochrom (Cytochrom a3 oder Cytochromoxidase) kann seine Elektronen direkt an molekularen Sauerstoff abgeben.
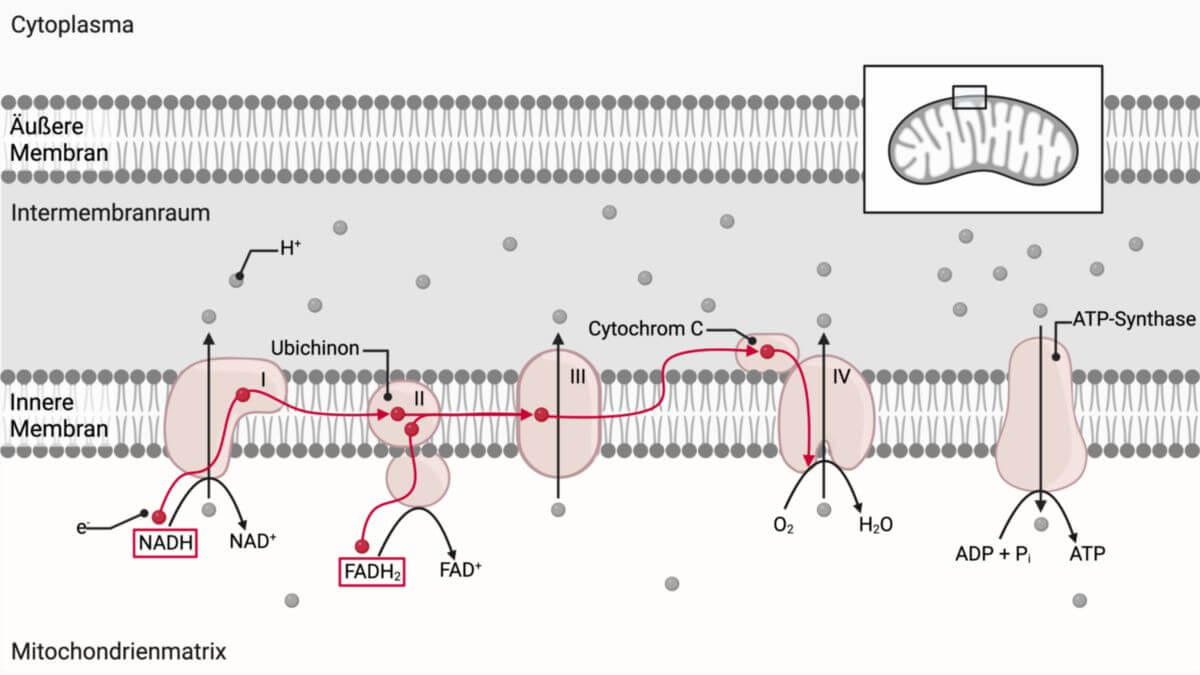
Komplexe
Die Atmungskette besteht aus vier großen Membranproteinkomplexen (I–IV), die Elektronen übertragen und dabei Protonen pumpen.
Die vier Komplexe der Atmungskette sind:
- Komplex I: NADH-Dehydrogenase
- Komplex II: Succinatdehydrogenase
- Komplex III: Cytochrom-c-Reduktase
- Komplex IV: Cytochrom-c-Oxidase
Der dadurch erzeugte Protonengradient treibt die ATP-Synthase an, sie wird auch als Komplex V bezeichnet.
Der Elektronenweg der beiden Reduktionsäquivalente über die Komplexe lautet wie folgt:
- NADH → Komplex I → Ubichinon → Komplex III → Cytochrom c → Komplex IV → O2
- FADH2 → Komplex II → Ubichinon → Komplex III → Cytochrom c → Komplex IV → O2
Komplex I: NADH-Dehydrogenase
Die in den katabolen Stoffwechselwegen anfallenden NADH-Moleküle werden per Malat-Aspartat-Shuttle in den Matrixraum der Mitochondrien transportiert. NADH überträgt dann Elektronen in Form ein Hydridion (H-) auf Flavinmononukleotid (FMN), das als prosthetische Gruppe an Komplex I gebunden ist. Von dort werden die Elektronen über Eisen-Schwefel-Cluster im Komplex I weitergeleitet und reduzieren schließlich Ubichinon (Q) zu Ubihydrochinon (QH2). Die hierfür benötigten Protonen stammen aus dem Matrixraum.
Die frei werdende Energie treibt den Transport von vier Protonen in den Intermembranraum an.
Komplex II: Succinatdehydrogenase
Der Komplex II ist zugleich ein Enzym des Citratzyklus. Er katalysiert die Oxidation von Succinat zu Fumarat und reduziert dabei FAD zu FADH2. Die Elektronen werden über Eisen-Schwefel-Cluster auf Ubichinon übertragen (Q → QH2). Die beiden nötigen Protonen für diese Reduktion stammen vom zuvor oxidierten FADH2. Die an diesem Komplex ablaufenden Reaktionen haben dementsprechend keinen Transport von Protonen zur Folge. Dadurch ist die Energiekonservierung geringer als bei Eintritt über Komplex I.
Komplex III: Cytochrom-c-Reduktase
Der Komplex III oxidiert QH2 und überträgt die Elektronen auf Cytochrom c (daher Cytochrom-c-Reduktase). Als Elektronenüberträger dient dem Komplex III Cytochrom b, in dem die Häm-Zentren Häm-bL und Häm-bH enthalten sind. Da QH2 zwei Elektronen liefert, Cytochrom c aber nur eines aufnehmen kann, erfolgt die Elektronenübertragung über den Q-Zyklus.
Dabei werden insgesamt vier Protonen in den Intermembranraum befördert:
- 2 H+ stammen direkt aus QH2 (Freisetzung nach außen)
- 2 H+ werden aus dem Matrixraum aufgenommen und nach außen verschoben
Komplex IV: Cytochrom-c-Oxidase
Der Komplex IV überträgt Elektronen schließlich von Cytochrom c auf Sauerstoff und reduziert diesen zu Wasser. Cytochrom c wird dabei oxidiert, daher der Name Cytochrom-c-Oxidase. Das Reaktionszentrum enthält u.a. Häm- und Kupferkomplexe (Häm a, Häm a3, CuA, CuB).
Die Sauerstoffreduktion ist der energetisch günstigste Schritt der Atmungskette (größtes Redoxpotential) und erfolgt kontrolliert, um die Bildung reaktiver Sauerstoffspezies zu minimieren. Zwei Elektronen werden auf ein halbes O2-Molekül übertragen, wobei Wasser (H2O) entsteht. Diese Reaktion wird als Knallgasreaktion bezeichnet und ist die exergonste Teilreaktion der Atmungskette. Dabei werden zwei Protonen aktiv in den Intermembranraum transportiert und zwei Protonen in der Matrix für die Wasserbildung verbraucht.
Für die Arbeit des Komplexes IV ist Sauerstoff als finaler Elektronenakzeptor unersetzlich. Dies ist der Hauptgrund, warum Lebewesen Sauerstoff zum Leben benötigen.
Komplex V: ATP-Synthase
Die ATP-Synthase ist ein rotierender Enzymkomplex ("Nanomotor"). Protonen fließen entlang ihres Gradienten aus dem Intermembranraum zurück in die Matrix und treiben dabei die Synthese von ATP aus ADP und Pi an.
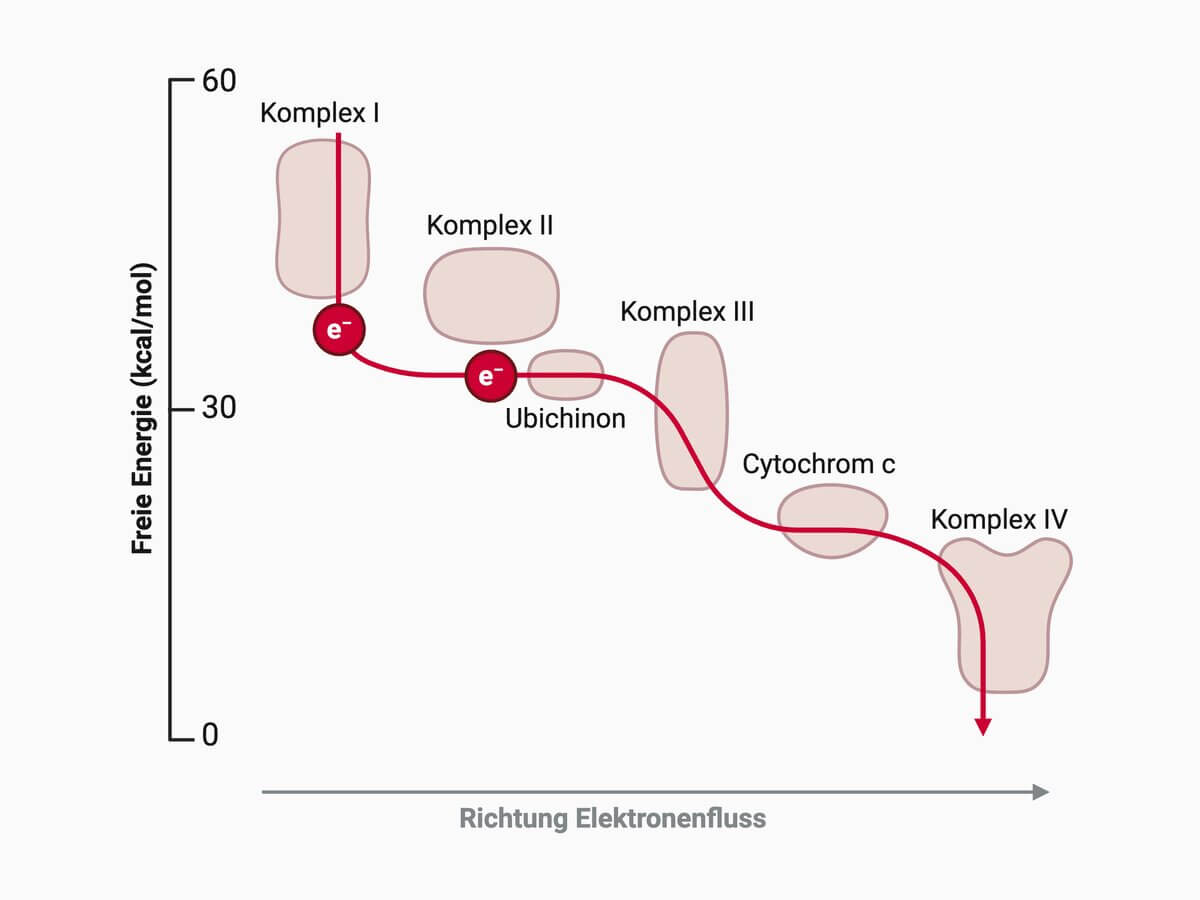
Energetik des Elektronentransportes
Die Oxidation der verschiedenen Reduktionsäquivalente wird als "Fluss" beschrieben, weil die freie Reaktionsenthalpie der einzelnen Redox-Prozesse an den Komplexen der Atmungskette immer stärker negativ wird. Diese im Gesamten stark exergonen Prozesse befähigen die Komplexe zum Transport von Protonen. Durch die protonenmotorische Kraft (basierend auf pH-Gradient und Membranpotential) wird die ATP-Synthase angetrieben.
Die Protonenbilanz pro oxidiertem Reduktionsäquivalent beträgt:
- pro NADH: ca. 10 H+ (Komplex I: 4, Komplex III: 4, Komplex IV: 2)
- pro FADH2: ca. 6 H+ (Komplex II: 0, Komplex III: 4, Komplex IV: 2)
Für die Synthese von einem Molekül ATP werden (inklusive Transportprozesse) im Mittel etwa vier Protonen benötigt. Daraus ergeben sich typische P/O-Verhältnisse:
- ca. 2,5 ATP pro NADH
- ca. 1,5 ATP pro FADH2
Die Kopplung zwischen Elektronentransport und ATP-Synthese wird als chemiosmotische Kopplung beschrieben. Entkoppler ermöglichen einen Protonenrückfluss unter Umgehung der ATP-Synthase. Dadurch wird Energie überwiegend als Wärme frei.
Zählt man alle bei der Oxidation von Glucose ablaufenden Dehydrierungsschritte zusammen, werden bei der vollständigen Oxidation von einem Molekül Glucose zu Kohlendioxid und Wasser insgesamt zwölf Elektronenpaare über die Atmungskette auf molekularen Sauerstoff übertragen. Der damit verbundene Elektronentransport liefert etwa –624 kcal/mol oxidierter Glucose. Im Vergleich zur freien Enthalpieänderung der vollständigen Verbrennung von Glucose (–686 kcal/mol) zeigt dies, dass bei der biologischen Glucoseoxidation nahezu die gesamte Energie über den enzymatischen Elektronentransport vom ersten Elektronenakzeptor (NAD) bis zum Sauerstoff freigesetzt wird.
Klinik
Störungen der Atmungskette treten z.B. bei Mitochondriopathien auf, die durch Mutationen oder Deletionen in der mitochondrialen oder nukleären DNA verursacht werden. Besonders betroffen sind energieabhängige Gewebe wie ZNS, Skelettmuskel und Myokard.
Weiterhin hemmen verschiedene Substanzen die mitochondriale Atmungskette. Dazu gehören z.B.:
- Komplex I: Rotenon, Amobarbital
- Komplex III: Antimycin A
- Komplex IV: Cyanid, Kohlenmonoxid, Azid, Stickstoffmonoxid (reversible Hemmung von Komplex IV)