Cytochrom-c-Oxidase
Abkürzung: COX
Synonym: Cytochrom c: Sauerstoff Oxidoreduktase, Komplex IV
Englisch: cytochrome c oxidase
Definition
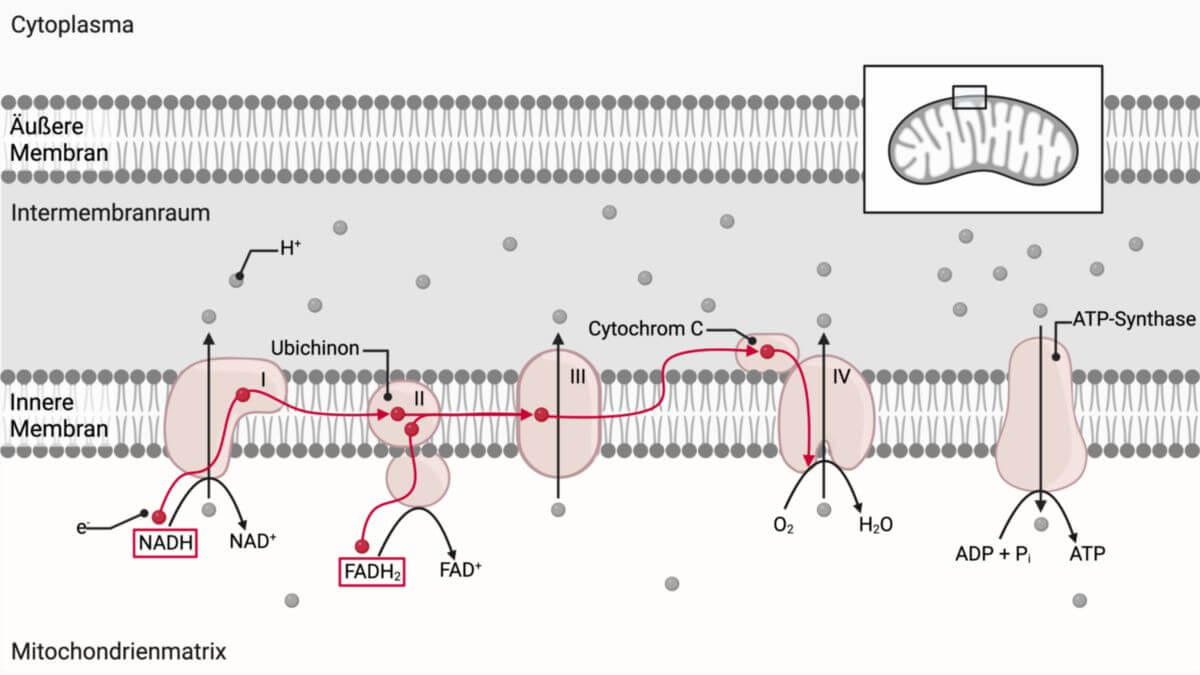
Bei der Cytochrom-c-Oxidase (COX) handelt es sich um einen Komplex der mitochondrialen Atmungskette, welcher die Oxidation von Cytochrom c und die damit verbundenen Elektronenübertragung und Reduktion von O2 zu H2O katalysiert.
Aufbau
Die COX ist als großer Enzymkomplex in der inneren Mitochondrienmembran verankert und besteht aus 13 Proteinuntereinheiten. 10 dieser Untereinheiten sind nucleär kodiert und werden während der Translation mit Hilfe von HSP70-Chaperonen und dem TOM/TIM-Transporterkomplex in das Mitochondrium importiert, die übrigen 3 Untereinheiten sind auf der mitochondrialen DNA kodiert und werden von der mitochondrialen Transkriptions- und Translationsmaschinerie gebildet. Die COX enthält als zentrale Zentren je zwei Kupferkomplexe CuA und CuB sowie zwei Hämgruppen Häm a und Häm a3, welche beide ein zentrales Eisenatom Fe3+ enthalten. CuA und Häm a dienen als Elektronenüberträger, CuB und Häm a3 bilden das binukleäre Zentrum zur Sauerstoffreduktion.
Katalysierte Reaktion
Die Reaktion, welche die COX katalysiert, ist die Reduktion von elementarem Sauerstoff zu Wasser mit Hilfe von 4 Elektronen sowie 4 Protonen. Die Reaktionsgleichung lautet dabei:
- 1O2 + 4Cyt C [Fe2+] ---> 2O2- + 2Cyt C [Fe3+]
- 2O2- + 4H+ ---> 2H2O
Bei dieser Reaktion werden 4 Protonen von der mitochondrialen Matrix in den Intermembranraum transportiert, wodurch dort ein Protonengradient gegenüber der Matrix entsteht, welcher von der ATP-Syntase (Komplex V) zur ATP-Synthese per oxidativer Phosphorylierung genutzt wird.
Das reduzierte Cytochrom C [Fe2+] erreicht dabei zunächst die Häm a Gruppe, deren zentrales Eisenatom mit einem positiveren Redoxpotential als Cytochrom C in der Lage ist, dieses zu oxidieren.
Da sowohl Cytochrom C als auch die Häm-Gruppe ein zentrales Eisenion als Reaktionszentrum besitzen, welches jeweils durch ein Elektron reduziert/oxidiert werden kann, benötigt es vier Redox-Zyklen zur Reduktion von 1O2
Anschließend wird das Elektron auf das binukleäre Zentrum bestehend aus Häm a3 und CuB übertragen, wodurch das zentrale Kupferion Cu2+ zu Cu1+ reduziert wird. Ein weiteres Elektron reduziert das zentale Eisenatom Fe3+ zu Fe2+ und sättigt damit das binukleäre Zentrum. Die Bindung eines O2 an das Zentrum führt zur Reoxidation und Formal zur Bildung eines gebundenen Peroxidanions O22-. Dieses wird mit Hilfe eines weiteren Elektrons aus einem benachbarten Tyrosinrest gespalten und zu einer Hydroxylgruppen HO- reduziert, welche an das CuB gebunden ist.
Das dritte, aus der Oxidation von Cyotochrom C gewonnene Elektron reduziert das entstandene Tyrosylradikal und das vierte Elektron reduziert das vebleibende Sauerstoffion, sodass eine zweite, diesmal an das Häm a3 gebundene Hydroxylgruppe entsteht. Dank der Bereitstellung eines dritten Elektrons durch den Tyrosinrest wird die Bildung von Sauerstoff- oder Hyrodxylradikalen effektiv verhindert.
Inhibition
Die Sauerstoffbindungsstelle am binukleären Zentrum kann von einigen Substanzen gehemmt werden. Darunter unter anderem Cyanid (CN-), Azid (N3-), Kohlenmonoxid (CO), Schwefelwasserstoff (H2S) oder Stickstoffmonoxid (NO)
Nachweis
Nachgewiesen werden kann die COX über den Oxidasetest.