Glykogensynthese
Synonyme: Glykogenese, Glykogenbildung, Glykogenie
Englisch: glycogenesis
Definition
Die Glykogensynthese ist ein in der Zelle ablaufener biochemischer Prozess, bei dem aus Glukose der Speicherstoff Glykogen, ein hoch verzweigtes Homoglykan, gebildet wird.
Der umgekehrte Vorgang wird als Glykogenolyse bezeichnet.
Ablauf
Übersicht
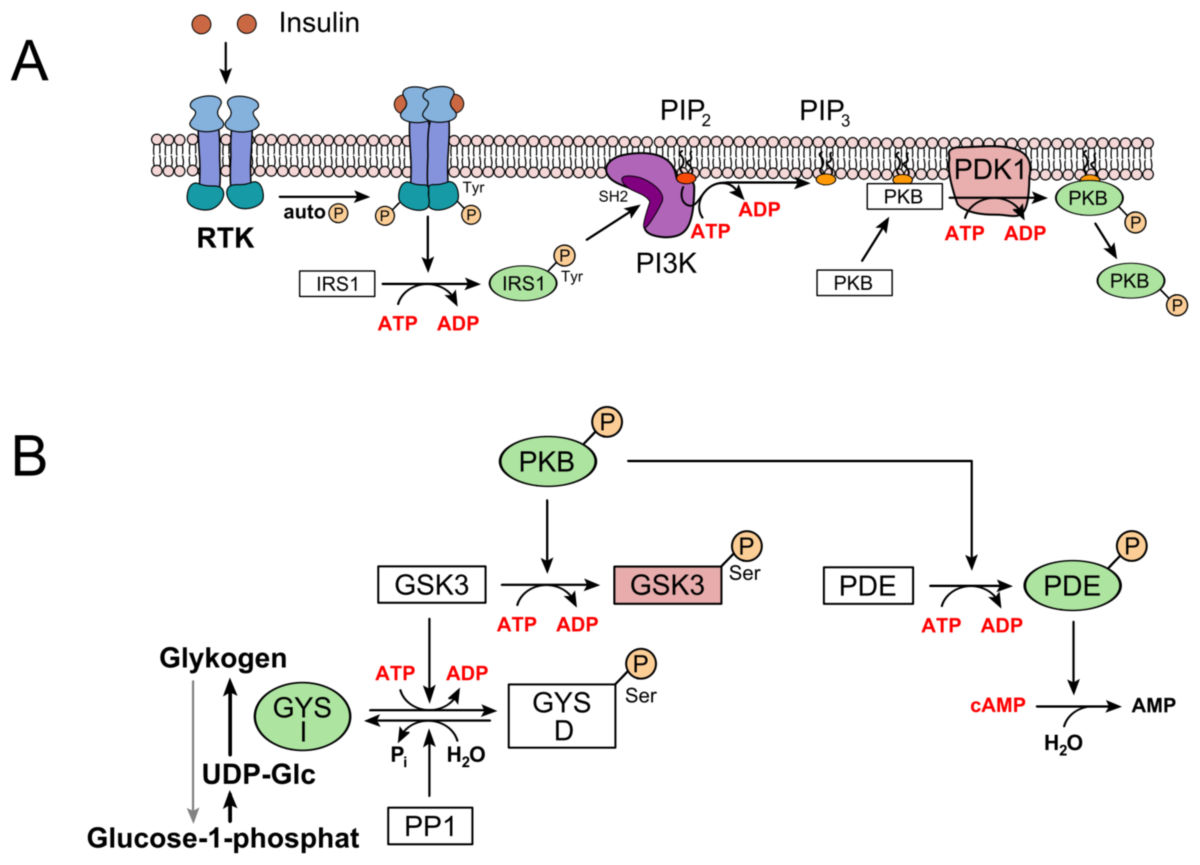
Die Glykogensynthese läuft im Cytosol ab. Sie findet überwiegend in den Hepatozyten der Leber und in den Myozyten der Skelettmuskulatur statt und wird durch zum Teil unterschiedliche Hormone stimuliert. Die Aufnahme der Glukose, und die damit einher gehende Bildung des Glykogens ist ein wichtiger Mechanismus der Regulierung des Blutglukosegehalts.
Voraussetzungen
Der Aufbau von Glykogen ist eine indirekte Folge einer erhöhten Blut-Glukose-Konzentration, beispielsweise nach der Aufnahme von Glukose aus den Kohlenhydraten der Nahrung. So dient beispielsweise ein aus α-D-Glukose-Einheiten bestehendes, verzweigtes Homopolymer (die Stärke; auch Amylum genannt) als wichtigste Kohlenhydratquelle des Menschen.
Die glykosidischen Bindungen dieses Makromoleküls werden im Rahmen der Verdauung durch Enzyme (z.B. Amylase) gespalten. Die entstehende Glukose wird durch die Enterozyten über SGLT-1 ("sodium dependend glucose transporter") - also natriumabhängige Glukose-Transportproteine - resorbiert und über basolaterale GLUT-2-Transporter in den Blutkreislauf weitergereicht. Der gestiegene Glukosespiegel im Blut führt zu einer höheren Aktivität der GLUT-2-Transporter der β-Zellen des endokrinen Pankreas, so dass der Einstrom von Glukose in diese β-Zellen ansteigt. Dadurch wird eine Kaskade angestoßen, an deren Ende die die Ausschüttung von Insulin steht. Die Insulinkonzentration im Blut erhöht sich, wodurch die Glykogensynthese, und die damit einhergehende Senkung des Blutglukosespiegels, stimuliert wird.
Phosphorylierung
Zunächst wird die Glukose, die von den Zellen über GLUT-2 (z.B. in Hepatozyten, Nieren und β-Zellen des Pankreas) oder GLUT-4-Transporter (Skelettmuskel, Fettgewebe) via erleichterter Diffusion aufgenommen wurde, phosphoryliert. Die Isoenzyme Glucokinase (v.a. Leber) und Hexokinase (v.a. Skelettmuskel) übertragen eine Phosphatgruppe von ATP auf das C6-Atom der Glukose, worauf diese in Glukose-6-phosphat umgewandelt, und ADP frei wird. Glukose-6-phosphat kann die Zelle nicht mehr verlassen, und dient als Ausgangspunkt für die weiteren Schritte der Glykogensynthese. Dieser Schritt ist irreversibel.
Phosphoglucomutase
Die Phosphoglucomutase (PGM) isomerisiert Glukose-6-phosphat zu Glukose-1-phosphat. Hierbei handelt es sich um einen reversiblen Schritt. Diese Phosphatgruppenübertragung vom C6- auf das C1-Atom der Glukose ist die Voraussetzung für die nachfolgenden Reaktionen, durch die eine 1,4-glykosidische Bindung geknüpft werden soll.
UMP-Übertragung
Glukose-1-phosphat ist in der Folge Substrat der UTP-Glukose-1-phosphat-Uridylyltransferase oder alternativ auch der UDP-Glukose-Pyrophosphorylase, einem Enzym aus der Klasse der Transferasen, welches UTP unter Übertragung von UMP auf den Phosphatrest von Glukose-1-phosphat, sowie Abspaltung von Pyrophosphat, aufspaltet. Die Tatsache, dass dieser Schritt irreversibel ist, ist dem Umstand geschuldet, dass eine Pyrophosphatase das entstehende Pyrophosphat in einer exergonen Reaktion hydrolytisch spaltet. Dadurch wird das Pyrophosphat - also ein Produkt der von der UDP-Glukose-Pyrophosphorylase katalysierten Reaktion - dem chemischen Gleichgewicht entzogen, wodurch die Triebkraft für diesen Schritt erhöht wird.
Glykogensynthese
Ein wichtiger Faktor der Glykogensynthese ist Glycogenin, ein zytoplasmatisches Protein, das sich insbesondere durch seine Fähigkeit zur Autoglukosylierung auszeichnet. Als das sogenannte Verankerungsprotein des Glykogens, ist es als Ursprungspunkt eines jeden Glykogenpolymers zu betrachten. Die Autoglukosylierung beschreibt in diesem Fall die Initiation der Synthese einer Glykogenkette, die durch Übertragung eines wiederum von UDP-Glukose stammenden Glukosylrestes auf einen definierten Tyrosinrest (TYR-194) des Glykogenins, ermöglicht wird. Darüber hinaus ist das Enzym in der Lage, diesen Ausgangskomplex um weitere Glukosebausteine zu verlängern bis etwa acht α-1,4-glykosidisch verknüpfte Glukose-Elemente einen Primer für die weitere Verlängerung der Kette durch die Glykogensynthase bilden.
Der so entstandene Primer ist die Voraussetzung für die Funktion des Schlüsselenzyms der Glykogenese, der Glykogensynthase. Dieses Enzym überträgt die Glukose nun unter Ausbildung einer α-1,4-glykosidischen Verknüpfung an das nicht-reduzierende Ende (also das freie C4-Atom) eines bereits bestehenden Glykogenmoleküls, welches dabei um einen Glukose-Baustein verlängert wird. Da die Verknüpfung zwischen dem C4-Atom des terminalen Glukosemoleküls des Glykogens und dem zunächst noch an UDP-gebundenen C1-Atom der UDP-Glukose liegt, geht die Verlängerung der Glykogenkette mit der Abspaltung von UDP einher. Pro Glukosemolekül, welches glykosidisch an das Glykogen geknüpft wird, wird also auch ein UDP frei.
Die Glykogensynthase ist in ihrem Handlungsspielraum jedoch insofern eingeschränkt, als dass sie einerseits ausschließlich in beschriebener Art und Weise α-1,4-glykosidisch die Glykogenkette verlängern und somit keine Verzweigungen, sondern ausschließlich eine lineare Glykogenkette synthetisieren kann, und andererseits dadurch, dass sie eine bereits bestehende Akzeptorkette benötigt, auf die sie dann die Glukosylreste, welche von der UDP-Glukose stammen, übertragen kann. Die Glykogensynthase kann also nicht Glukosemonomere glukosylieren, sondern benötigt einen Startkomplex, bestehend aus mindestens vier Glukoseresten. Um diesen Unzulänglichkeiten des Enzyms beizukommen, sind noch zwei weitere Enzyme für die Glykogen-Synthese von Bedeutung.
Verzweigungsenzym
Eine der wichtigsten Eigenschaften des Glykogens ist sein hoher Verzweigungsgrad, da dadurch auch die Mobilisierbarkeit des Moleküls aufgrund der zahlreichen nicht-reduzierenden Enden, welche ja als Ausgangspunkte sowohl für die Glykogensynthese, als auch für den Glykogenabbau dienen. Durch zahlreiche Verzweigungen, die durch α-1,6-glykosidische Bindungen, zwischen denen jeweils etwa 8-12 α-1,4-glykosidisch-verknüpfte Glukoseeinheiten liegen, erhält das Glykogen seine charakteristischen chemischen Eigenschaften: Rascher Abbau, schneller Aufbau durch zahlreiche Verzweigungen und damit zahlreiche nicht-reduzierende Enden.
Zu diesem Zweck gibt es neben der Glykogensynthase ein sogenanntes Verzweigungsenzym, häufig auch mit der englischen Bezeichnung "branching enzyme" aufgeführt, welches die α-1,6-glykosidischen Verbindungen knüpft, und damit den Verzweigungsgrad des Moleküls erhöht. Der chemische Name dieses Enzyms lautet α-1,4-α-1,6-Transglucosidase. Dieses Enzym katalysiert zunächst die Spaltung einer α-1,4-glykosidischen Bindung eines Glukoserestes, an dessen C1-Atom allerdings noch 6 weitere Glukosebausteine α-1,4-glykosidisch geknüpft sind, und daraufhin die Knüpfung einer α-1,6-glykosidischen Bindung dieser siebengliedrigen Glukosekette mit dem C6-Atom einer anderen Glukoseeinheit.