Succinatdehydrogenase
Synonyme: Succinat-Dehydrogenase, Komplex II
Englisch: succinate dehydrogenase
Definition
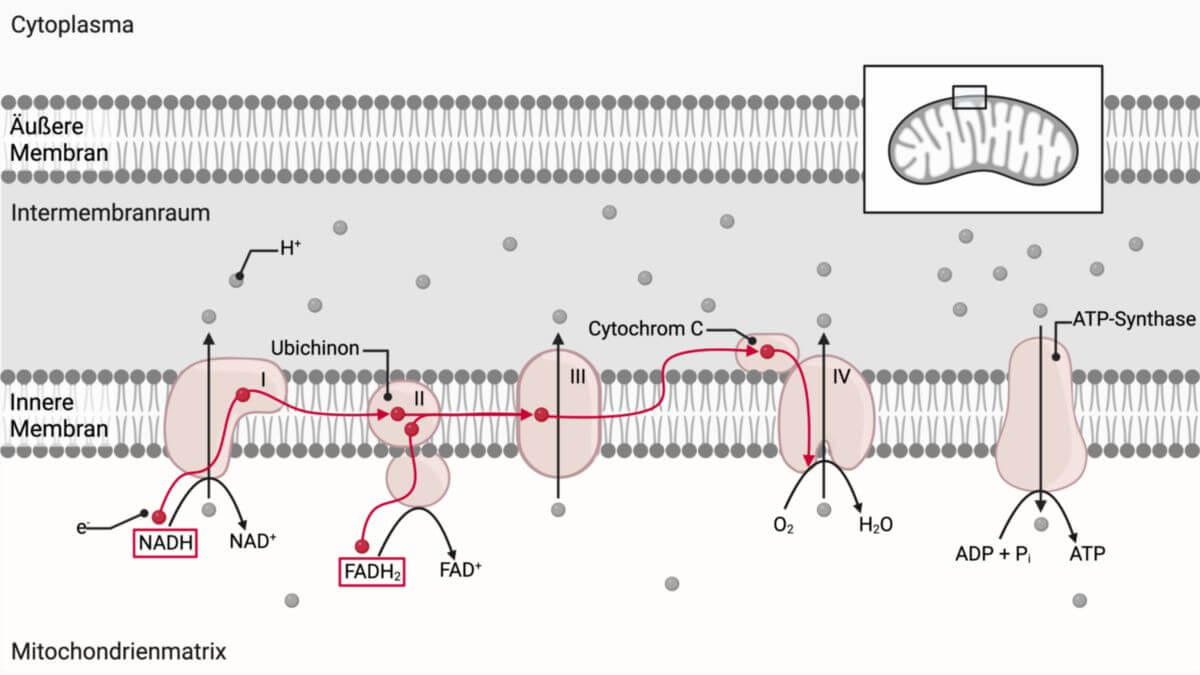
Die Succinatdehydrogenase ist ein Enzymkomplex, der im Citratzyklus und in der Atmungskette als Komplex II die Reaktion von Succinat zu Fumarat katalysiert. Er kommt sowohl bei vielen Bakterien als auch in den Mitochondrien von Eukaryoten vor.
Biochemie
Die Succinatdehydrogenase besteht aus vier Untereinheiten:
- 2 hydrophile Untereinheiten
- SdhA: ein Flavoprotein mit kovalent gebundenem FAD und einer Succinat-Bindungsstelle
- SdhB: ein Protein mit drei Eisen-Schwefel-Clustern ([2Fe-2S], [4Fe-4S] und [3Fe-4S])
- 2 hydrophobe Untereinheiten
- SdhC: 18.6 kDa Membranprotein, das den Enzymkomplex in der inneren Mitochondrienmembran verankert
- SdhD: 17 kDa Membranprotein, das den Enzymkomplex in der inneren Mitochondrienmembran verankert
Aufgabe
Die Succinatdehydrogenase oxidiert Succinat, ein Zwischenprodukt des Citratzyklus, zu Fumarat. Dabei werden Elektronen freigesetzt, die an den Elektronentransport übergeben werden. Die Succinatdehydrogenase spielt auf diese Weise eine wichtige Rolle bei der Umwandlung von chemischer Energie in elektrische Energie während des oxidativen Stoffwechsels.
SdhB, SdhC und SdhD bilden eine Tasche, in der Ubichinon gebunden ist. Bei der Reaktion werden zwei Wasserstoffatome von Succinat auf FAD übertragen, das zu FADH2 reduziert wird. FADH2 überträgt diese wiederum an Ubichinon, das zu Ubichinol reduziert wird. Zusätzlich akzeptiert die Succinatdehydrogenase Elektronen von Succinat und überträgt sie auf Ubichinon, das anschließend an den Komplex III übergeben wird. Dadurch bildet die Succinatdehydrogenase eine Verbindung zwischen dem Citratzyklus und dem Elektronentransport der Atmungskette.
siehe auch: Atmungskette