Graft-versus-Host-Reaktion
Synonyme: Graft-versus-Host-Erkrankung, Transplantat-gegen-Wirt-Reaktion
Englisch: graft-versus-host disease, graft-versus-host reaction
Definition
Als Graft-versus-Host-Reaktion, kurz GvHD oder GvHR, wird eine systemische, zytotoxische Reaktion von implantierten bzw. transfundierten Immunzellen gegen den Wirtsorganismus bezeichnet.
- ICD10-Code: T86.0
Abgrenzung
Eine erwünschte Form der Graft-versus-Host-Reaktion ist die Graft-versus-Leukemia-Reaktion.
Ätiologie
Eine GvHR kann entstehen, wenn allogene T-Zellen auf einen immungeschwächten Transplantatempfänger übertragen werden. Dies ist zum Beispiel der Fall bei:
- Allogener Stammzelltransplantation: Häufigste Ursache einer GvHR. In 30 bis 60 % der Fälle kommt es zu einer akuten, in ca. 50 % zu einer chronischen Reaktion; ein wesentlicher Teil der Therapiemortalität wird der GvHR zugeschrieben.
- Blutprodukttransfusionen auf immundefiziente Patienten (selten; durch Bestrahlung und Leukozytendepletion vermeidbar)
Sehr selten tritt eine GvHR bei Transplantation solider Organe auf, dann meist bei lymphozytenreichen Organen wie Darm, Pankreas oder Leber.
Pathogenese
Die Graft-versus-Host-Reaktion entsteht durch die Übertragung immunkompetenter Zellen mit dem Transplantat, die ursprünglich aus dem Knochenmark, aus der Milz oder aus den Lymphknoten des Spenders stammen. Transplantierte T-Zellen erkennen das Gewebe des Empfängers als fremd, wodurch im Empfängerorganismus zelluläre Immunreaktionen ausgelöst werden. Zur Fremderkennung der Empfänger-Antigene kommt es, weil die allogenen T-Zellen nur für die MHC-präsentierbaren Peptide des Spenders, nicht aber des Empfängers eine Immuntoleranz ausgebildet haben.
Allogene T-Zellen werden von einer immunkompetenten Person rasch durch eigene T-Zell-Reaktionen beseitigt. Bei immungeschwächten Wirten können dagegen schwere Erkrankungen, wie Hepatosplenomegalie, Atrophie der lymphatischen Organe, Diarrhoe, Hautveränderungen und Kachexie auftreten, unter Umständen mit tödlichem Ausgang.
Eine GvHR tritt auch bei einer kompletten (10/10) Übereinstimmung der HLA-Merkmale auf (Histokompatibilität), da die Erkennung über die Bindung von Minor-Histokompatibilitätsantigenen an den passenden T-Zell-Rezeptor verläuft. In der Folge werden spezifische, gegen den Wirt gerichtete, zytotoxische T-Zellen und Antikörper gebildet. Zudem werden auch Reaktionen des angeborenen Immunsystems vermutet.
Die Pathogenese der Graft-versus-Host-Reaktion läuft in der Modellvorstellung in drei Phasen ab:[1]
- Afferente Phase: Durch Bestrahlungs- und Chemotherapie vor der Transplantation entstehen Schäden im Empfängergewebe. Dies führt zur Freisetzung bzw. zur erhöhten Konzentration von PAMPs, DAMPs und inflammatorischen Zytokinen (IL-1, IL-6, TNF-α). Zusätzlich werden MHC-Antigene exprimiert, die den transplantierten T-Zellen von antigenpräsentierenden Zellen (APCs) angeboten werden.
- Efferente Phase: Es kommt zur Interaktion zwischen den transplantierten T-Zellen und den APCs. Diese proliferieren und differenzieren zu aktiven T-Zellen, die ebenfalls inflammatorische Zytokine (IL-2, IFN-γ) freisetzen.
- Effektor-Phase: Anschließend migrieren allogene zytotoxische T-Lymphozyten und NKT-Zellen in verschiedene Gewebe bzw. Organe. Dort rufen sie Entzündungsreaktionen hervor.
Bei der chronischen Graft-versus-Host-Reaktion laufen sowohl alloreaktive als auch autoreaktive immunologische Prozesse ab. Eine gestörte periphere Immuntoleranz ist mit einem Mangel an regulatorischen T-Zellen assoziiert. In der Folge entwickelt sich eine chronische Entzündungsreaktion mit konsekutiver Fibrosierung.
Histopathologie
Risikofaktoren
Allgemeine Risikofaktoren einer GvHR bei allogenen Gewebeübertragungen sind:
- HLA-Mismatch
- Nichtverwandtschaftlichkeit
- Infektionen des Empfängers
- Höheres Alter von Spender und Empfänger
- Verwendung von Blut- statt Knochenmarksstammzellen
Eine akute GvHR wird zudem durch die Konstellation weibliche Spenderin bei männlichem Empfänger begünstigt (Erkennung Y-chromosomal codierter Antigene) und findet sich häufiger bei vorangegangener Schwangerschaft einer Spenderin.
Klinik
Akute Graft-versus-Host-Reaktion
Die akute Graft-versus-Host-Reaktion tritt innerhalb der ersten 100 Tage nach Transplantation auf. Sie betrifft vor allem folgende Gewebe bzw. Organe:
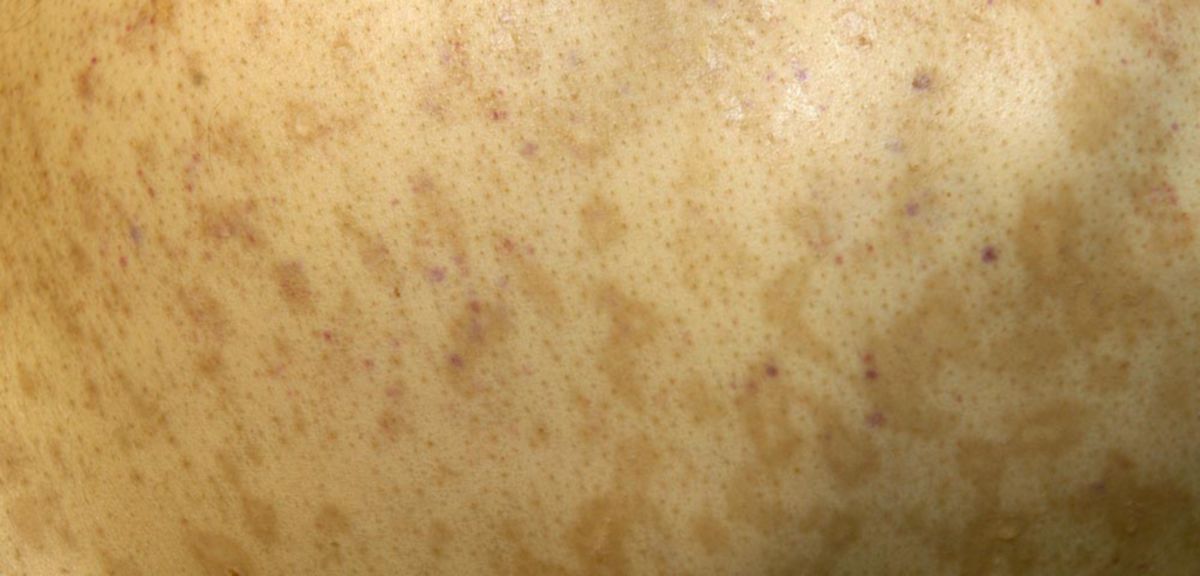
- Epithelzellen der Haut: makulopapulöses Exanthem, Erythrodermie; besonders betroffen sind lichtexponierte Hautareale
- Darm: Enteritis mit wässriger Diarrhoe (cave: ausgeprägter Flüssigkeitsverlust!) und Tenesmen
- Leber: Ikterus, Leberversagen
Sonderformen
- Late-onset akute Graft-versus-Host-Reaktion (LA GvHR): Tritt eine akute GvHR mit ihren typischen klinischen Charakteristika erstmalig nach 100 Tagen auf, spricht man von einer late onset akuten Graft-versus-Host-Reaktion.
- Persistierende und rekurrierende akute Graft-versus-Host-Reaktion
Chronische Graft-versus-Host-Reaktion
Die chronische Graft-versus-Host-Reaktion tritt frühestens nach 100 Tagen auf. Sie wird begleitet von entzündlichen Veränderungen. Das klinische Erscheinungsbild ist vielfältig und kann ggf. wie eine Kollagenose imponieren. Häufig sind folgende Organe betroffen:
- Haut und Schleimhäute: sklerodermiforme und/oder lichenoide Veränderungen
- Augen: Keratokonjunktivitis sicca
- Magen-Darm-Trakt: Ösophagusstrikturen, Diarrhö, Übelkeit, Pankreasinsuffizienz (exokrin und endokrin)
- Muskuloskelettales System: Fasziitis, Myositis, Kontrakturen, Gelenkversteifungen
- Lunge: Bronchiolitis obliterans
Diagnostik
Akute Graft-versus-Host-Reaktion
Zunächst erfolgt die klinische und laborchemische Diagnostik. Für die Sicherung eines Darm-Befalls ist eine Biopsie des jeweiligen Gewebes notwendig. Auf eine Gewebeprobe der Haut und Leber kann verzichtet werden, wenn keine relevanten Differentialdiagnosen (z.B. Zytomegalie) vorliegen.
Die Ausprägung des Krankheitsbildes wird je nach betroffenem Organ nach folgenden Kriterien beurteilt:
- Haut: Ausdehnung des Erythems (in Prozent der Körperoberfläche)
- Darm: Anzahl der Stuhlabgänge pro Tag, Menge der Diarrhö (in ml pro Tag)
- Leber: Bilirubinkonzentration im Serum
In Gewebeproben sind lymphozytäre Infiltrationen, Zellschäden und Zelluntergänge zu finden.
Chronische Graft-versus-Host-Reaktion
Die Diagnose wird üblicherweise anhand der Klinik gestellt. Ist die Abgrenzung zu anderen Erkrankungen schwierig, sollte eine histologische Sicherung erfolgen. Die radiologische Diagnostik ist z.B. bei pulmonaler Manifestation wegweisend. Bei okulärer GvHR sollte eine ophtalmologische Mitbeurteilung erfolgen.
Therapie
Akute Graft-versus-Host-Reaktion
Therapeutisch kommen je nach Schweregrad neben einer Intensivierung (oder erneutem Beginn) der Immunsuppression, insbesondere hochdosierte Kortikosteroide zum Einsatz. Bei fehlender Besserung kann eine Behandlung mit TNF-α-Antikörpern erwogen werden. Eine weitere Therapiemöglichkeit liefert zudem die extrakorporale Photophorese (ECP).
Darüber hinaus befinden sich Chemoimmunkonjugate in klinischer Forschung, die gegen NK-Zellen und T-Zellen gerichtet sind.
In vielen Fällen ist eine supportive Therapie notwendig. Dazu gehören Analgesie, Flüssigkeitssubstitution, parenterale Ernährung und antibiotische, antivirale oder antimykotische Therapie.
Chronische Graft-versus-Host-Reaktion
Zur Therapie werden topische und systemische Kortikosteroide verabreicht. Schwere Verlaufsformen werden ähnlich wie die akute GvHR mit Immunsuppressiva oder ggf. extrakorporaler Photopherese behandelt. Bei Versagen der Erstlinientherapie kommt der ROCK2-Inhibitor Belumosudil in Betracht. Eine supportive Therapie mit z.B. Antiinfektiva, Physiotherapie oder psychologischer Betreuung ist ebenfalls sinnvoll.
Prophylaxe
Aufgrund des oftmals komplikativen Verlaufs der akuten Graft-versus-Host-Reaktion kommt der Prophylaxe mittels medikamentöser Immunsuppression eine große Bedeutung zu. Üblicherweise wird eine Kombination aus einem Calcineurininhibitor (z.B. Cyclosporin A, Tacrolimus) mit Methotrexat oder Mycophenolat eingenommen. Bei Patienten mit nichtverwandten Stammzellspendern wird zudem häufig Antithymozytenglobulin (ATG) eingesetzt.
Grundsätzlich ist eine solche Prophylaxe für alle Patienten nach der Transplantation indiziert, die Dauer und Intensität hängt jedoch von dem individuellen Risiko und dem weiteren Erkrankungs- bzw. Therapieverlauf ab. Die immunsuppressive Behandlung erfolgt im Gegensatz zu Organtransplantationen in der Regel nicht dauerhaft, sondern wird sukzessive in der Dosis reduziert und im Verlauf ausgeschlichen.
Granulozyten- und Thrombozytenkonzentrate werden vor der Transfusion bestrahlt, um eine GvHR zu verhindern.
Literatur
- Onkopedia: Leitlinie akute GvHD, Stand 2020 abgerufen 06/2021
- Onkopedia: Leitlinie chronische GvHD, Stand 2019 abgerufen 06/2021
Quelle
- ↑ National Library of Medicine. Graft-Versus-Host-Disease. StatPearls. Abgerufen am 07.07.2023