Etrasimod
Handelsname: Velsipity®
Synonyme: APD-334, Etrasimodum, Etrasimodarginat
Englisch: etrasimod, etrasimod arginine
Definition
Etrasimod ist ein Arzneistoff aus der Gruppe der S1P-Rezeptormodulatoren, der zur Behandlung der Colitis ulcerosa (CU) eingesetzt wird. Der Wirkstoff supprimiert die Einwanderung von Immunzellen aus den Lymphknoten in den Darm, wodurch die Entzündungsprozesse im Darm und andere Symptome der Erkrankung unterdrückt werden.
Chemie
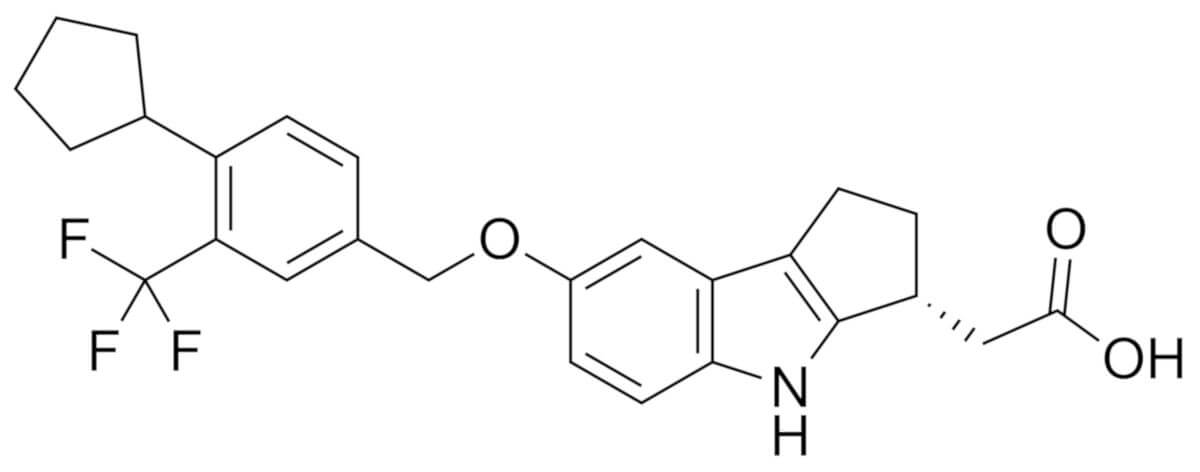
Etrasimod ist eine heterotrizyklische organische Verbindung, bei der es sich um 1,2,3,4 Tetrahydrocyclopenta[b]indol handelt, das durch Carboxymethyl- und [4-Cyclopentyl-3- (trifluormethyl)phenyl]methoxygruppen in den Positionen 3R bzw. 7 substituiert ist. Die Summenformel ist C26H26F3NO3. Der chemische Name lautet
- 2-[(3R)-7-[[4-Cyclopentyl-3-(trifluoromethyl)phenyl]methoxy]-1,2,3,4-tetrahydrocyclopenta[b]indol-3-yl]essigsäure (IUPAC)
Die molare Masse beträgt 457,5 g/mol, der Oktanol-Wasser-Koeffizient (logP) 5,73. Die CAS-Nummer ist 1206123-37-6. Als Arzneistoff wird Etrasimodarginat (molare Masse 631,69 g/mol; CAS 1206123-97-8) verwendet, ein bei Raumtemperatur weißer, cremefarbener bis hellbrauner Feststoff, der in Wasser leicht löslich ist.[1]
Wirkmechanismus
Die Migration von Immunzellen aus den Lymphorganen ins Blut und in die Lymphe wird maßgeblich durch den Sphingosin-1-phosphat-Rezeptor (S1P-Rezeptor) reguliert. Etrasimod ist ein Sphingosin-1-Phosphat-Rezeptor-Modulator, der mit hoher Affinität an die S1P-Rezeptoren 1, 4 und 5 bindet, aber nur eine minimale Affinität zu S1P3 und keine Affinität zu S1P2 aufweist. An S1P1 wirkt Etrasimod auch als G-Protein- und β-Arrestin-Agonist.[1][2]
Etrasimod führt zu einer partiellen und reversiblen Retention der Lymphozyten in den lymphatischen Organen. Die Anzahl der Lymphozyten im peripheren Blut (Abnahme um durchschnittlich 45 %) und die Zahl der aktivierten Lymphozyten im Gewebe werden reduziert.[1]
Der genaue Wirkmechanismus von Etrasimod bei CU ist derzeit (2024) noch nicht bekannt. Der therapeutische Effekt ist wahrscheinlich auf die Unterdrückung der Migration von Lymphozyten in die intestinalen Entzündungsherde zurückzuführen. Von dieser Suppression sind vor allem Zellen betroffen, die an der adaptiven Immunantwort bei der CU beteiligt sind. Zellen, die an der angeborenen Immunantwort beteiligt sind und zur Immunüberwachung beitragen, sind nur in geringem Maße betroffen.[1][2]
Pharmakokinetik
Etrasimod wird nach oraler Aufnahme langsam, aber gut resorbiert. Maximale Plasmaspiegel werden nach 4 Stunden (Bereich 2 bis 8 Stunden) erreicht. Der Steady State wird innerhalb einer Woche nach Behandlungsbeginn erreicht. Die mittlere maximale Plasmakonzentration liegt dann bei 113 ng/ml. Die Plasmaproteinbindung beträgt 97,9 %, das Verteilungsvolumen bei 66 Liter (ca. 1 l/kgKG).
Die Biotransformation in der Leber erfolgt hauptsächlich durch Oxidation und Dehydrierung über die Cytochrom-P450-Isoenzyme CYP2C8 (38 %), CYP2C9 (37 %) und CYP3A4 (22 %), mit geringen Anteilen über CYP2C19 und CYP2J2. Durch UDP-Glucuronosyltransferase und Sulfotransferasen wird Etrasimod konjugiert. Die Elimination erfolgt überwiegend mit den Fäzes. Die Eliminationshalbwertszeit beträgt 30 Stunden.[2]
Indikation
Etrasimod ist indiziert zur Behandlung von Patienten ab 16 Jahren mit mittelschwerer bis schwerer aktiver Colitis ulcerosa (CU), die auf eine konventionelle Therapie oder ein Biologikum nicht oder nur unzureichend ansprechen oder diese nicht vertragen.[2]
Darreichungsform
Etrasimod steht in Form von Filmtabletten zur oralen Anwendung zur Verfügung.
Dosierung
Die empfohlene Dosis beträgt einmal täglich 2 mg. Die Einnahme sollte mit der Nahrung erfolgen, um die bradykardisierende Wirkung abzuschwächen.
Eine Dosisanpassung bei Leber- und Nierenfunktionsstörungen ist nicht erforderlich.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Die häufigsten unerwünschten Wirkungen von Etrasimod sind:[1][2]
- Kopfschmerzen
- erhöhte Leberenzyme (AST, ALT, GGT)
- Schwindel
Durch die Lymphopenie besteht ein erhöhtes Infektionsrisiko, insbesondere der Harnwege, der Atemwege und für Infektionen durch Herpesviren. Bei weniger als 200 Lymphozyten/µl ist die Therapie zu unterbrechen. Auf Symptome einer progressiven multifokalen Leukenzephalopathie muss geachtet werden.
Es kann zu Hypertonie, Ausprägung eines posterioren reversiblen Enzephalopathie-Syndroms, Bradyarrhythmie und Verlängerung der atrioventrikulären Überleitungszeit kommen.
Einschränkungen der Lungenfunktion (Reduktion der Einsekundenkapazität FEV1) können auftreten.
Das Risiko für die Entwicklung eines Makulaödems ist erhöht (Klasseneffekt von S1P-Agonisten).
Das Risiko für das Auftreten kutaner Malignome (Basalzellkarzinom, Plattenepithelkarzinom, Melanom, Kaposi-Sarkom, Merkelzellkarzinom) ist ebenfalls erhöht.
Wechselwirkungen
Die gleichzeitige Anwendung von Inhibitoren der Cytochrom-P450-Isoenzyme CYP2C8, CYP2C9 und CYP3A4 kann zur Verstärkung, die Anwendung von Induktoren dieser Isoenzyme zur Verminderung der Wirkung von Etrasimod führen.[2]
Die Auswirkungen der gleichzeitigen Einnahme von Betablockern, Calciumantagonisten oder Arzneimitteln haben, die ein Long-QT-Syndrom auslösen, wurden bisher (2024) nicht untersucht.[2] Es ist jedoch davon auszugehen, dass diese Arzneimittel die kardiovaskulären Nebenwirkungen von Etrasimod verstärken.
Durch eine vorangehende Behandlung mit immunsuppressiven oder immunmodulierenden Arzneimitteln kann es zu additiven Effekten auf das Immunsystem kommen, die auch vier bis fünf Wochen nach dem Absetzen von Etrasimod noch bestehen.[1][2]
Die Wirksamkeit von Impfungen kann während der Behandlung mit Etrasimod abgeschwächt sein. Lebendimpfstoffe sollten mindestens 4 Wochen vor Therapiebeginn verabreicht werden und während sowie bis mindestens 2 Wochen nach der Behandlung nicht durchgeführt werden.[2]
Kontraindikationen
Die Anwendung von Etrasimod ist kontraindiziert bei:[1][2]
- Überempfindlichkeit gegen Etrasimod oder einen der sonstigen Bestandteile des Arzneimittels
- Myokardinfarkt, instabiler Angina pectoris, Schlaganfall, transitorischen ischämischen Attacken (TIA) oder dekompensierter Herzinsuffizienz (Klasse III/IV NYHA) in den letzten 6 Monaten
- AV-Block 2. Grades vom Typ Mobitz II oder 3. Grades, Sick-Sinus-Syndrom, sinuatrialem Block, es sei denn, der Patient hat einen Herzschrittmacher
- Immundefizienz
- schweren aktiven Infektionen oder aktiven chronischen Infektionen wie Hepatitis oder Tuberkulose
- aktiven Malignomen
- schwerer Leberfunktionsstörung
- Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine wirksame Empfängnisverhütung anwenden
- Stillzeit
Schwangerschaft und Stillzeit
In Tierversuchen mit Etrasimod wurden reproduktionstoxische Wirkungen und ein Übertritt in die Muttermilch festgestellt. Bei Anwendung im ersten Trimester der Schwangerschaft kann es beim Menschen zu Fehlbildungen kommen. Vor Beginn der Behandlung müssen Frauen im gebärfähigen Alter über dieses Risiko für den Fötus informiert werden, einen negativen Schwangerschaftstest haben und während der Behandlung und für mindestens 14 Tage nach Therapieende eine wirksame Empfängnisverhütung anwenden. Während der Behandlung darf nicht gestillt werden.[2]
Toxizität
Es liegen aktuell (2024) keine Erfahrungen mit der Überdosierung oder Vergiftung mit Etrasimod vor. Es ist davon auszugehen, dass es zu einer schweren kardiovaskulären Symptomatik kommen kann. Eine primäre Giftentfernung durch die Gabe von Aktivkohle kann innerhalb einer Stunde nach der Ingestion erfolgen. Die weitere Behandlung erfolgt in jedem Fall symptomatisch. Ein spezifisches Antidot ist bisher (2024) nicht verfügbar. Bei einer Bradykardie sollte mit Atropin behandelt werden. Unter Umständen ist eine temporäre Versorgung mit einem Herzschrittmacher erforderlich. Aufgrund seiner pharmakokinetischen Eigenschaften (hohe Plasmaproteinbindung) ist eine sekundäre Giftentfernung durch Hämodialyse nicht effektiv.
Kosten
Die Behandlungskosten für eine einjährige Erhaltungstherapie mit täglich 2 mg Velsipity® werden derzeit (Stand Juni 2024) mit 15.582 Euro angegeben.[5]
Nutzenbewertung
Nach Einschätzung des IQWiG liegen keine geeigneten Daten vor, die einen Zusatznutzen von Etrasimod gegenüber einer zweckmäßigen Vergleichstherapie aufzeigen. Der Zusatznutzen sei damit nicht belegt.[6]
ATC-Code
- L04AE05 - Immunsuppressiva - selektive Immunsuppressiva
Quellen
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Full Prescribing Information Velsipity, FDA, abgerufen am 12.07.2024
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 Zusammenfassung der Merkmale des Arzneimittels Velsipity, EMA, abgerufen am 12.07.2024
- ↑ Shirley M. Etrasimod: First Approval. Drugs. 2024
- ↑ Velsipity. EMA, abgerufen am 12.07.2024
- ↑ Angabe nach arznei-telegramm 2024, abgerufen am 13.07.2024
- ↑ IQWiG: Nutzenbewertung gemäß $35a SGB V – Etrasimod vom 8.7.2024
Weblinks
- Drugbank - Etrasimod, abgerufen am 12.07.2024
- Pharmazeutische Zeitung Arzneistoffe - Etrasimod, abgerufen am 12.07.2024
- Gelbe Liste Wirkstoffe - Etrasimod, abgerufen am 12.07.2024
- PharmaWiki - Etrasimod, abgerufen am 12.07.2024
- PubChem: 44623998
- MeSH: 2049891