Tubulärer Transport
Synonyme: Modifikation des Primärharns, tubuläre Reabsorption
Definition
Als tubulären Transport bezeichnet man in der Physiologie die Gesamtheit aus Resorptions- und Sekretionsmechanismen von Stoffen im proximalen und distalen Tubulus eines Nephrons.
Hintergrund
Der Primärharn, der durch Ultrafiltration des Blutes in den Nierenkörperchen entsteht, wird im Tubulus zu Sekundärharn modifiziert. So wird die Abgabe von ausscheidungspflichtigen Verbindungen sicher gestellt und gleichzeitig die Ausscheidung von Elektrolyten und organischen Verbindungen wie Glukose und Harnstoff reguliert.
Prinzip
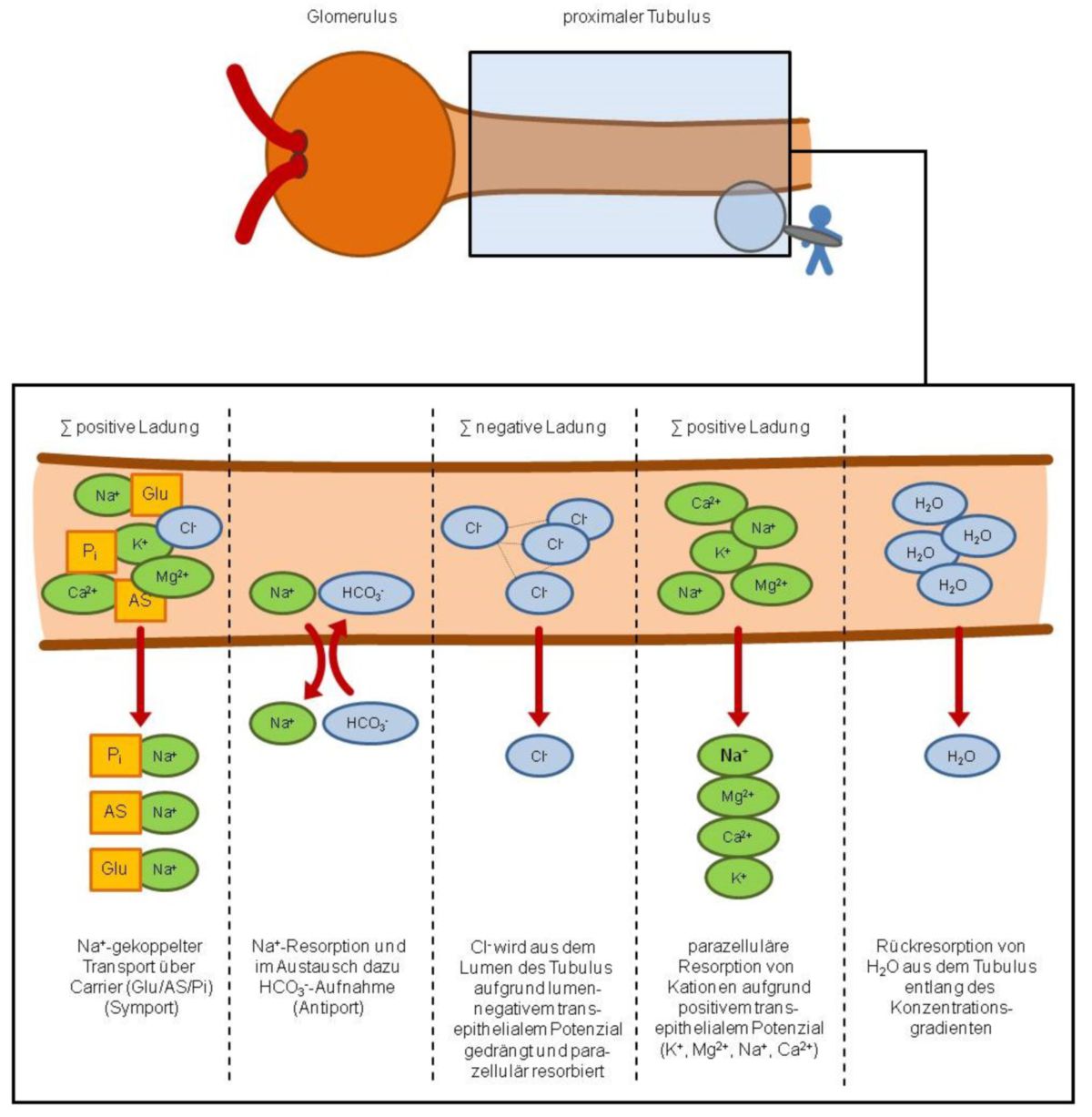
Der proximale Tubulus eines Nephrons umfasst das proximale Konvolut inklusive des dicken absteigenden Teils der Henle-Schleife. Dieser Abschnitt spielt mengenmäßig die bedeutendste Rolle für die Rückresorption der ins Ultrafiltrat gefilterten Stoffe. So werden hier ca. 2/3 des Wassers und des NaCl, 95 % des Bikarbonats und praktisch 100 % der filtrierten Glukose und Aminosäuren isoosmotisch rückresorbiert.
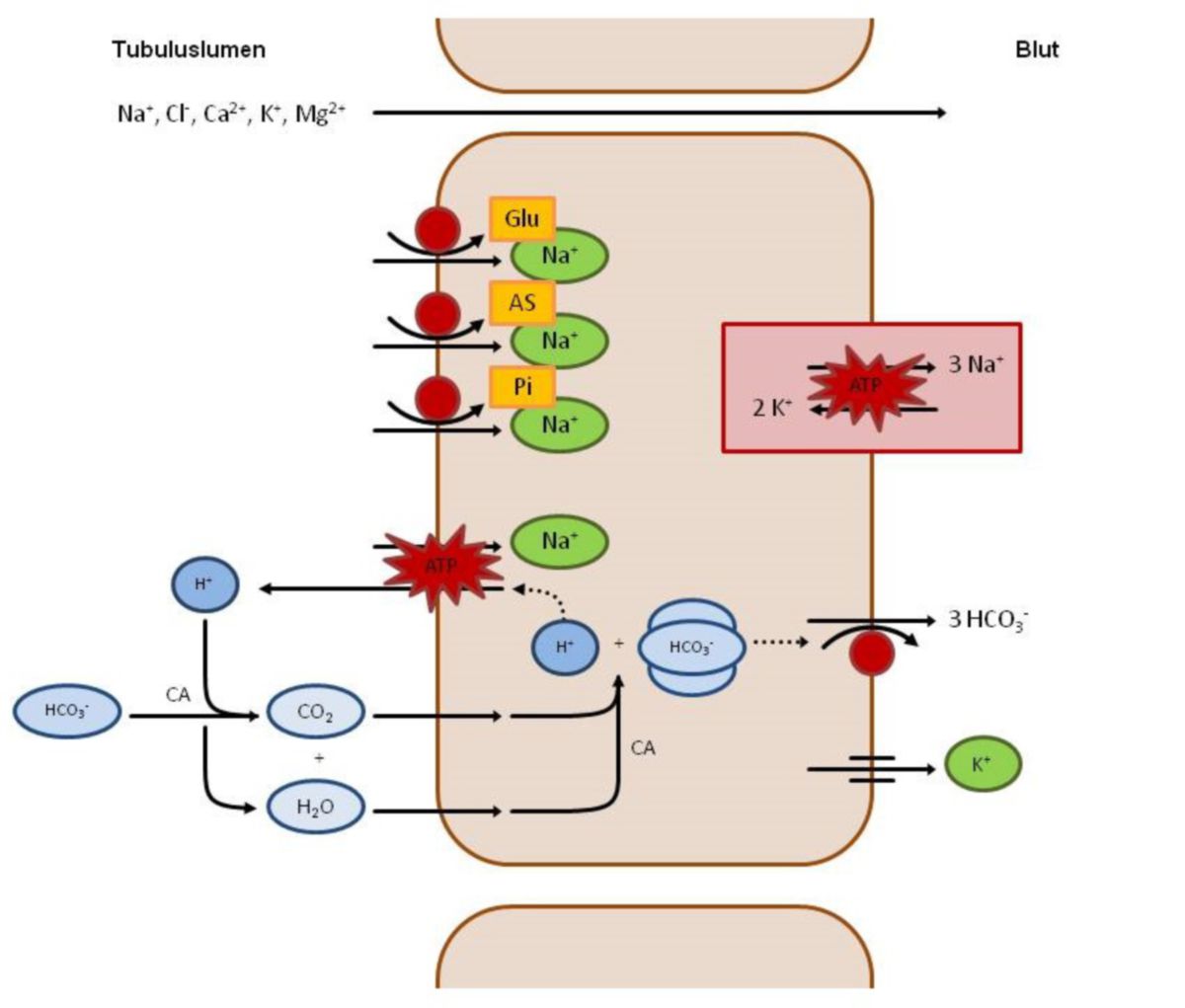
Dieser Tubulusabschnitt besitzt zwar eine hohe Transportkapazität, kann jedoch keinen hohen Gradienten aufbauen. Aufgrund dessen ist die treibende Kraft für die Resorption in erster Linie der elektrochemische Na+-Gradient. Dieser wird mithilfe der an der basolateralen Seite lokalisierten Na+-K+-ATPase aufrechterhalten. Gleichzeitig ermöglicht er eine Reihe Na+-gekoppelter Transportprozesse (NaCl, Glukose, Aminosäuren, Phosphat, organische Säuren, usw.).
So wird im früh-proximalen Tubulus Na+ über verschiedene Symporter (z.B. Glukose, Aminosäuren, Phosphat) und über Antiporter (z.B. Bikarbonat) resorbiert. Diese Carrier sind größtenteils elektrogen, d.h. die elektrische Ladung des Tubulusinhalts verändert sich insofern, dass die Transportprozesse vorwiegend positive Ladungen aus dem Tubuluslumen entfernen. Im Anschluss entsteht ein lumennegatives transepitheliales Potenzial, das wiederum die negativ geladenen Cl--Ionen aus dem Lumen drängt, so dass diese parazellulär resorbiert werden können. Gleichzeitig können in dem Wasserstrom, der entsteht, weitere gelöste Teilchen mitgerissen werden (Solvent Drag).
Aufgrund der zunehmenden Cl--Ionen-Resorption aus dem Tubuluslumen ändert sich wiederum das transepitheliale Potenzial, bis es im weiteren Verlauf des proximalen Tubulus schließlich wieder lumenpositiv wird. Diese positive Ladungssituation ermöglicht dann die parazelluläre Resorption von positiv geladenen Ionen, wie Na+, K+, Ca2+, Mg2+. Außerdem verfügt der proximale Tubulus neben Resorptionsmechanismen auch über Sekretionsmechanismen, die zur Ausscheidung von Fremdstoffen sowie organischen Säuren oder Basen dienen (z.B. Penicillin, Furosemid, Harnsäure).
Jene Flüssigkeit, die im proximalen Tubulus resorbiert wurde, gelangt über die sogenannten peritubulären Kapillaren wieder zurück in den Kreislauf. Der Einstrom in die Kapillaren ist jedoch abhängig vom hydrostatischen und onkotischen Druck in den peritubulären Kapillaren und im Interstitium sowie der Permeabilität der Kapillaren: Hierbei senken die Widerstandsgefäße (Vas afferens, Vas efferens) den Druck in den peritubulären Kapillaren auf etwa 10 mmHg, während im Interstitium durch die Salz- und Wasserresorption aus dem Tubulus der hydrostatische Druck (RIHP) verhältnismäßig hoch ist. Gleichzeitig herrscht in den Kapillaren ein hoher onkotischer Druck, da durch die Filtration einer eiweißfreien Flüssigkeit die Proteinkonzentration in den Kapillaren erhöht ist. Beide Tatsachen fördern wiederum den Einstrom von Flüssigkeit aus dem Interstitium zurück in das Gefäßbett.
Resorptionsmechanismen
Glukose
Glukose, ein relativ kleines Molekül, wird frei filtriert. Im Ultrafiltrat entspricht die Glukosekonzentration also derjenigen im Plasma und liegt beim Gesunden (nüchtern) in etwa bei 0,8-1,0 g/l. Normalerweise wird Glukose über einen sogenannten sekundär-aktiven Na+-Glukose-Symport im proximalen Tubulus praktisch wieder vollständig rückresorbiert. Steigt jedoch die Glukosemenge, so nimmt die Rückresorption zunächst proportional zu, bis die Glukosekonzentration die Sättigungskonzentration des Glukose-Carriers (Schwellenwert in etwa bei 1,8-2,0 g/l) überschritten hat. Ab diesem Zeitpunkt kann die Rückresorption nicht noch weiter gesteigert werden, da bereits alle Carrier maximale Arbeit leisten. Die so im Tubulus verbleibende Glukose wird dann mit dem Urin ausgeschieden, man spricht dann von einer Glukosurie. Sie führt aufgrund der osmotischen Wirksamkeit von Glukose zu einer vermehrten Wasserausscheidung (Polyurie), die der Körper mit einer erhöhten Wasseraufnahme (Polydipsie) auszugleichen versucht.
Aminosäuren
Aminosäuren werden auf einem ähnlichen Weg wie die Glukose resorbiert, d.h., dass die meisten filtrierten Aminosäuren im proximalen Tubulus mithilfe sekundär-aktiver Na+-Symporte rückresorbiert werden. Hierzu dienen verschiedene Transportsysteme, die dabei jeweils für unterschiedliche, jedoch strukturell verwandte Aminosäurengruppen spezifisch sind (saure Aminosäuren, basische Aminosäuren, neutrale Aminosäuren). Werden vermehrt Aminosäuren mit dem Urin ausgeschieden, so spricht man von einer (Hyper-)Aminoazidurie. Ursachen hierfür können entweder prärenal (durch erhöhte Plasmakonzentration und anschließende Überschreitung der Transportkapazität der Carrier) oder renal (z.B. durch Defekte im Transportsystem) lokalisiert sein. Da die Transporter relativ spezifisch arbeiten, kann auch nur eine Gruppe von Aminosäuren betroffen sein, wie z.B. bei einer Zystinurie. Gleichzeitig jedoch können sich Aminosäuren, die den selben Carrier benutzen, gegenseitig kompetitiv in ihrer Resorption hemmen. Liegt also ein Überangebot von Arginin vor, kommt es auch gleichzeitig zu einer vermehrten Ausscheidung von Lysin und Ornithin, da diese Aminosäuren alle den selben Transporter verwenden.
Peptide und Proteine
Oligopeptide werden zum größten Teil in der luminalen Membran des proximalen Tubulus durch für sie spezifische Hydrolasen in Dipeptide und Aminosäuren zerlegt. Im Anschluss erfolgt die Resorption. Es gibt jedoch bestimmte Oligopeptide und auch verschiedene Proteine, die im Ganzen per Endozytose aufgenommen werden. Diese werden dann erst intrazellulär hydrolysiert, wobei ihre Spaltprodukte anschließend ins Interstitium abgegeben werden. Im Normalfall wird jedoch eine nennenswerte Ausscheidung von Proteinen dadurch verhindert, dass sie im proximalen Tubulus resorbiert werden. Weist der Glomerulus jedoch eine erhöhte Durchlässigkeit auf oder besteht ein tubulärer Defekt, so erhöht sich der Proteinanteil im Urin (Proteinurie). Die Größe der Proteine kann Aufschluss darüber geben, welcher Teil des Nephrons wahrscheinlich geschädigt ist. Liegt ein glomerulärer Schaden vor (z.B. Glomerulonephritis, nephrotisches Syndrom) ist in den meisten Fällen die Filterfunktion gestört, sodass auch größere Proteine, wie z.B. Albumin, in das Ultrafiltrat gelangen. Tubuläre Schäden hingegen enthalten im Ultrafiltrat in der Regel kleine Proteine, v.a. β2-Mikroglobulin.
Natrium
Na+ wird grundsätzlich in allen Nephronsegementen resorbiert. Die treibende Kraft für die Na+-Resorption ist der elektrochemische Na+-Gradient. Dieser ermöglicht den gewünschten Na+-Einwärtsstrom, der wiederum mit weiteren sekundär-aktiven Co-Transporten gekoppelt ist (Na+-Glukose-Symport, Na+-Aminosäure-Symport, Na+-H+-Antiport, usw.). Hierbei wird ca. 1/3 des filtrierten Natriums im proximalen Tubulus wieder aufgenommen. Die restlichen 2/3 werden über parazelluläre Shunts und solvent drag resorbiert. Dabei folgen die Na+-Ionen den Cl--Ionen, die durch interzelluläre Spalten entlang ihres chemischen Gradienten aus dem Tubuluslumen diffundieren. Aufgrund der ständigen Resorption von Elektrolyten, Glukose und Aminosäuren sinkt die Anzahl osmotisch aktiver Teilchen im Tubuluslumen. Als Gegenreaktion strömt Wasser ebenfalls aus dem Tubuluslumen aus und reißt dabei wiederum weitere gelöste Teilchen (u.a. Na+ und Cl-, solvent drag) mit sich. Beim Gesunden wird so normalerweise nur ca. 1 % des filtrierten Na+ ausgeschieden. Dabei erfolgt die Regulation der Na+-Ausscheidung im spätdistalen Tubulus und im Sammelrohr durch Aldosteron und ANF.
Bikarbonat
Der größte Teil des anfallenden Bikarbonats (HCO3-) wird im proximalen Tubulus rückresorbiert. Hierbei ist zu beachten, dass die Rückresorption Na+-abhängig ist und mithilfe eines Na+/H+-Antiporters (NHE3) erfolgt. Dies geschieht, indem ein Na+ im Tausch gegen ein H+-Ion elektroneutral in die Zelle aufgenommen wird. Im Tubuluslumen angekommen reagieren die H+-Ionen mit HCO3- zu H2O und CO2. Das somit gebildete CO2 diffundiert in die Zelle und reagiert dort mit Wasser wieder zu HCO3- und H+.
Diese Reaktionen würden normalerweise nur sehr langsam ablaufen, weshalb in beiden Fällen eine α-Carboanhydrase (α-CA) als Katalysator unterstützend wirkt (CA-IV membranassoziert luminal und CA-II zytosolisch). Während das H+ erneut gegen ein Na+-Ion ausgetauscht werden kann, verlässt das intrazelluläre HCO3- die Zelle basolateral. Um auf die basolaterale Seite zu gelangen, stehen verschiedene Transportmechanismen zur Verfügung: Na+-HCO3--Symport, HCO3--CO32--Na+-Symport oder HCO3--Cl--Antiport. Diese werden durch Transporter der SLC4-Familie (z.B. NBC1 und AE1) bewerkstelligt. Betrachtet man die Bilanz, wird so Natrium und der größte Teil des filtrierten Bikarbonats resorbiert.
Kalzium
Etwa 40 % des gesamten Kalziums im Plasma sind an Albumin gebunden und werden aufgrund dessen erst gar nicht filtriert. Die übrigen 60 % werden etwa zu 2/3 ohne besondere Regulation im proximalen Tubulus und zu 1/3 unter dem Einfluss von Parathormon und Calcitriol im dicken aufsteigenden Teil der Henle-Schleife und im frühdistalen Tubulus rückresorbiert. Als treibende Kraft für die Ca2+-Resorption gilt das lumenpositive, transepitheliale Potenzial, das im mittleren bis späten proximalen Tubulus und im dicken aufsteigenden Teil der Henle-Schleife aufgrund der kontinuierlichen Cl--Resorption entsteht. Die Ca2+-Ausscheidung wird hormonabhängig im frühdistalen Tubulus reguliert: So führt eine Hyperkalzämie zu einer Hemmung der Resorption und fördert auf diesem Wege die Ca2+-Ausscheidung. Sowohl Parathormon als auch Calcitriol steigern jedoch die Ca2+-Resorption.
Kalium
Im proximalen Tubulus erfolgt eine ca. 60-70 %-ige K+-Resorption der filtrierten Menge und erfolgt daher ausschließlich passiv durch Diffusion und solvent drag. Im aufsteigenden, dicken Teil der Henle-Schleife werden in etwa weitere 25-35 % im Cotransport mit Na+ und Cl- resorbiert. Im distalen Tubulus und im Sammelrohr hingegen kann K+ entweder passiv (über sogenannte luminale K+-Kanäle) sezerniert oder aktiv (über eine H+/K+-ATPase) resorbiert werden. So ist die K+-Sekretion im distalen Tubulus an die Na+-Resorption gekoppelt. Liegt ein hohes Na+-Angebot im distalen Tubulus unter dem Einfluss von Aldosteron und bei hoher K+-Zufuhr vor, so ist sie gesteigert. Bei einer hohen H+-Sekretion (akute Azidose) ist sie hingegen vermindert.
Magnesium
Magnesium ist zu einem Teil an Plasmaproteine gebunden, weshalb es auch nur zu ca. 50-80 % filtriert werden kann. Die Resorption findet zum einen im proximalen Tubulus statt, wobei hier jedoch nur 30-40 % rückresorbiert wird. Der Großteil wird im dicken aufsteigenden Teil der Henle-Schleife durch den parazellulären Kanal Claudin-16 (auch Paracellin-1 genannt) wieder dem Körper zugeführt. Dieser Resorptionsvorgang wird von der positiven luminalen Spannung in diesem Abschnitt getrieben, die durch die Cl--Resorption entsteht. Im anschließenden distalen Tubulus werden nur noch weitere 2-5 % resorbiert, sodass insgesamt 5-10 % des ursprünglich filtrierten Magnesiums mit dem Urin ausgeschieden werden.
Phosphat
Phosphat ist wichtiger Bestandteil des Knochenaufbaus und in vielen energiereichen Stoffen vorhanden (z.B. ATP). Gleichzeitig spielt es als Phosphatpuffer eine Rolle in der pH-Regulation. Phosphat wird vor allem im Dünndarm resorbiert, bei Wiederkäuern zum Teil jedoch auch im Vormagensystem. In der Niere wird es fast unbehindert filtriert. Der Großteil der Resorption erfolgt vor allem im proximalen Tubulus durch den 3Na+/Phosphat-Symporter NaPi-IIa, auch Npt2a genannt, der gegen den elektrochemischen Gradienten arbeitet. Die Ausschleusung ins Blut erfolgt schlussendlich über einen Anionenantiporter im Austausch gegen 2 Anionen und eventuell auch durch einen Kanal. Die Resorption im distalen Tubulus hingegen ist minimal, sodass mit dem Harn letztendlich ca. 10-20 % ausgeschieden werden. Sieht man von der Plasmakonzentration ab, wird die Resorption wie folgt durch Hormone beeinflusst: Parathormon (PTH) und Calcitonin hemmen die Resorption, Calcitriol fördert sie. PTH hemmt die Resorption, indem es über die Aktivierung seines G-Protein-gekoppelten Rezeptors entweder über den cAMP-Weg oder über die Second Messenger IP3 und DAG die Internalisierung des NaPi-IIa-Symporters bewirkt. Auf diesem Wege kann die renale Phosphatresorption um bis zu 70% reduziert werden.
Sulfat
Sulfat wird hauptsächlich im proximalen Tubulus resorbiert. Es wird gemeinsam mit 3 Na+ durch den Symporter NaSi-1 aufgenommen und anschließend im Austausch gegen Anionen aus der Zelle ins Blut geschleust.
Harnsäure
Harnsäure stellt ein Endprodukt des Purinstoffwechsels dar und wird über die Niere ausgeschieden. Normalerweise werden im proximalen Tubulus über 90 % der filtrierten Harnsäure zunächst wieder resorbiert und ein Teil davon gegen Ende des proximalen Tubulus erneut sezerniert. So beträgt die Netto-Ausscheidung ca. 10 %. Da Harnsäure nur eine geringe, vom pH-Wert abhängige Wasserlöslichkeit besitzt, kann sie bei hoher Konzentration (Hyperurikämie) oder niedrigem pH-Wert ausfallen (v.a. in den Gelenken) und Urat-Kristalle bilden. Die Folgen sind schmerzhafte Entzündungsreaktionen (Gicht), wobei es in der Niere durch zusätzliche Uratablagerungen zu einer interstitiellen Nephritis oder zur Bildung von Harnsäuresteine führen kann.
Harnstoff
Harnstoff ist ebenso wie die Harnsäure ein Stoffwechselendprodukt, das gleichfalls über die Niere ausgeschieden wird. Bevor der Harnstoff den Körper jedoch endgültig verlässt, spielt er neben NaCl für den Aufbau des Konzentrationsgradienten noch eine wesentliche Rolle. Harnstoff ist ein kleines, ungeladenes Molekül, das frei filtriert wird und so durch die meisten biologischen Membranen gelangen kann. So sind der proximale Tubulus, der dünne Teil der Henle-Schleife und das papilläre Sammelrohr für Harnstoff gut permeabel.
Während der Harnstoff den proximalen Tubulus passiert, wird mehr als 50 % des filtrierten Harnstoffs mit dem Wasserstrom mitgerissen und resorbiert (solvent drag). Als kaum durchlässige Tubulusabschnitte gelten der dicke aufsteigende Teil der Henle-Schleife, das distale Konvolut und das erste Stück des Sammelrohrs. Da hier jedoch Wasser resorbiert wird, nimmt folglich die Harnstoffkonzentration zu. Gleichzeitig ist der papillennahe Abschnitt des Sammelrohrs (besonders bei Antidiurese in Anwesenheit von ADH) wieder permeabel für Harnstoff, sodass er zusammen mit Wasser das Tubuluslumen verlässt und ins Interstitium einwandert. Dort angekommen kann er entlang seines Konzentrationsgradienten erneut in den dünnen Teil der Henle-Schleife diffundieren.
Dies ist der Grund, weshalb der Harnstoff im Nierenmark regelrecht zirkuliert und so zu ca. 50 % zur Aufrechterhaltung der Hyperosmolarität beiträgt. Auf diesem Wege bleibt die NaCl-Konzentration niedrig genug, um noch eine passive NaCl-Resorption im inneren Mark zu ermöglichen. Im Normalfall werden schlussendlich 40 % des filtrierten Harnstoffs ausgeschieden, jedoch ist die Harnstoff-Clearance direkt von der glomerulären Filtrationsrate (GFR) und Diurese oder Antidiurese abhängig: Liegt eine niedrige glomeruläre Filtrationsrate oder starke Antidiurese vor, gelangt nur relativ wenig Wasser in das distale Sammelrohr, sodass sich die Harnstoffkonzentration erhöht und mehr Harnstoff rückresorbiert wird. Daher steigt die Harnstoffkonzentration im Nierenmark und letztlich auch im Plasma an. Bei einer starke Diurese hingegen bleibt die Harnstoffkonzentration aufgrund der großen Wassermenge im Sammelrohr niedrig, weshalb der Gradient gering ist und nur wenig Harnstoff ins Interstitium migrieren kann. Daher geht dort die Osmolarität immer weiter zurück (bis auf ca. 700 mosmol/l) worauf die Konzentrationsfähigkeit der Niere abnimmt.
Literatur
- Huppelsberg, Jens, and Kerstin Walter. Kurzlehrbuch Physiologie. Georg Thieme Verlag, 2013.
- Ecker, Katharina. Atmung & Niere. Das Skript der Physiologie für Veterinärmediziner Teil 3. BoD-Books on Demand, Norderstedt. 2016.