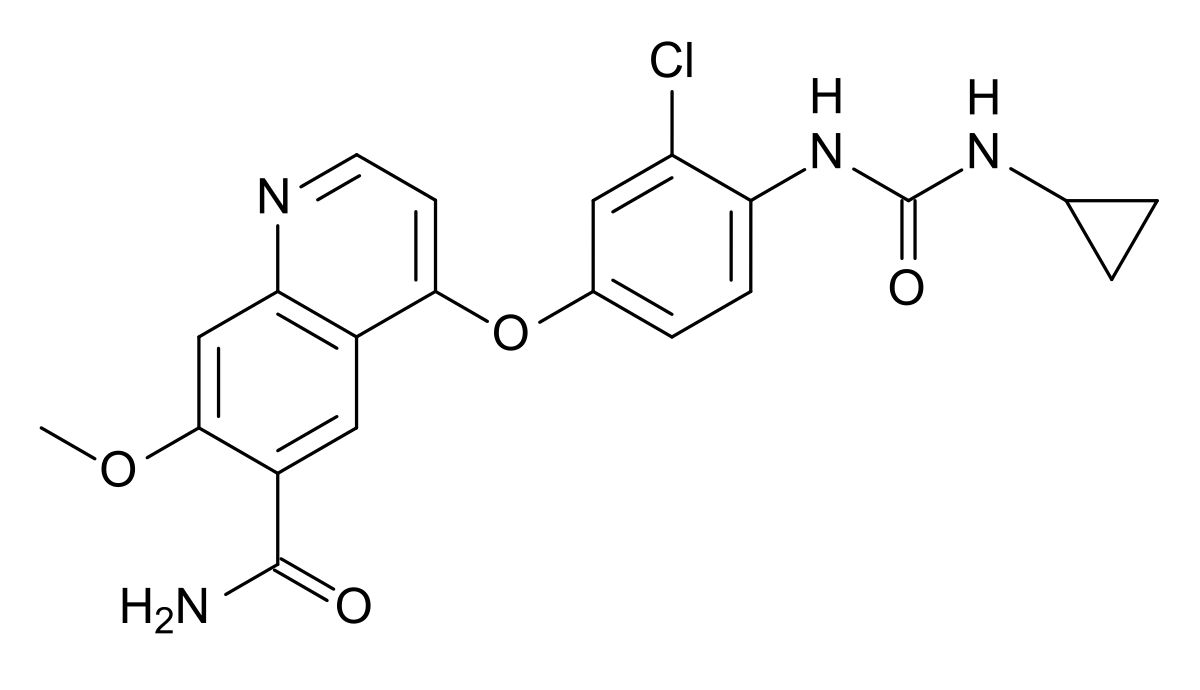
Lenvatinib
Handelsnamen: Lenvima®, Kisplyx®
Definition
Lenvatinib ist ein Arzneistoff aus der Gruppe der Multikinase-Inhibitoren. Er wird in der Onkologie zur Therapie von verschiedenen fortgeschrittenen oder rezidivierten Karzinomen angewendet.[1][2]
Chemie
Wirkmechanismus
Lenvatinib hemmt selektiv die Aktivität verschiedener Rezeptoren und zellulärer Zielstrukturen, die mit dem proangiogenen und onkogenen Signalweg in Zusammenhang stehen. Dazu gehören:
- die vaskulären Endothelwachstumsfaktor-Rezeptoren VEGFR 1 bis 3
- die Fibroblasten-Wachstumsfaktor-Rezeptoren FGFR 1 bis 4
- der Thrombozytenwachstumsfaktor-Rezeptor PDGFRα
- die Protoonkogene RET und KIT
Die Angioneogenese des Tumors wird dadurch gehemmt und neu gebildete Tumorzellen werden nicht mehr an das Gefäßsystem angeschlossen und mit Nährstoffen versorgt. Dadurch kommt es zu einer verlangsamten Tumorproliferation.
Pharmakokinetik
Maximale Plasmakonzentrationen werden 1 bis 4 Stunden nach oraler Einnahme erreicht. Die absolute Bioverfügbarkeit von Lenvatinib wurde nicht am Menschen untersucht.
Indikationen
Die Gabe von Lenvatinib ist bei erwachsenen Patienten in folgenden Fällen indiziert:
- Zur Behandlung des progressiven, lokal fortgeschrittenen oder metastasierten differenzierten Schilddrüsenkarzinoms, das nicht auf eine Radiojodtherapie (RAI) angesprochen hat. Zu den differenzierten Schillddrüsenkarzinomen zählen das papilläre und das follikuläre Schilddrüsenkarzinom sowie das Hürthle-Zell-Karzinom.[1]
- Zur Behandlung des fortgeschrittenen Nierenzellkarzinoms (RCC). Als Erstlinientherapie wird es in Kombination mit Pembrolizumab angewendet. Des Weiteren ist es im Rahmen einer Zweitlinientherapie in Kombination mit Everolimus nach einer vorangegangenen Behandlung mit einem VEGF-Inhibitor indiziert.[2]
- Als Monotherapie zur Behandlung des fortgeschrittenen oder inoperablen hepatozellulären Karzinoms (HCC), wenn zuvor keine systemische Therapie erfolgt ist.[1]
- Zur Behandlung des progredienten, fortgeschrittenen oder rezidivierenden Endometriumkarzinoms (EC) während oder nach vorheriger Platin-basierter Therapie, wenn eine kurative chirurgische Behandlung oder Radiotherapie nicht in Frage kommt.[1]
Dosierung
Die empfohlene Tagesdosis von Lenvatinib ist abhängig vom Indikationsgebiet und einer etwaigen Kombinationstherapie. Genaue Angaben sind der jeweiligen Fachinformation zu entnehmen.
Darreichungsform
Der Arzneistoff ist in Kapselform erhältlich.
Nebenwirkungen
Folgende Nebenwirkungen treten unter Lenvatinib sehr häufig (≥1:10) oder häufig (≥ 1:100, < 1:10) auf:
- Infektionen: Harnwegsinfekte
- Blut: Thrombozytopenie, Lymphopenie, Neutropenie, Leukopenie
- Nervensystem: Schwindel, Kopfschmerzen, Dysgeusie, Schlaganfall
- Haut: Hand-Fuß-Syndrom, Alopezie, Hautausschlag
- Endokrines System: Hypothyreose
- Gefäßsystem: Hypertonie, Blutung
- Psyche: Insomnie
- Stoffwechsel: Dehydratation, Gewichtsabnahme, Appetitlosigkeit, Hypokalzämie, Hypercholesterinämie, Hypokaliämie
- Gastrointestinaltrakt: Diarrhö, Erbrechen, Obstipation, Dyspepsie, Nausea
- Harnwege: Proteinurie
- Atemwege: Dysphonie
- Bewegungsapparat: Arthralgie, Muskelkrämpfe, Rückenschmerzen, Myalgien
- Allgemein: Fatigue, Asthenie, Ödeme, Unwohlsein
Wechselwirkungen
Eine Hemmung von CYP3A4 durch Lenvatinib kann nicht ausgeschlossen werden, was bei gleichzeitiger Einnahme von Substraten dieses Enzyms mit enger therapeutischer Breite berücksichtigt werden muss. Möglicherweise kann Lenvatinib die Wirksamkeit oraler Kontrazeptiva herabsetzen.
Kontraindikationen
- Überempfindlichkeit gegenüber dem Wirkstoff
- Schwangerschaft und Stillzeit
Zulassung
Das Arzneimittel ist in der EU seit 2015 als Orphan Drug für die Behandlung des fortgeschrittenen Schilddrüsenkarzinoms zugelassen. 2016 gab es eine Indikationserweiterung für die Behandlung des fortgeschrittenem Nierenzellkarzinoms und 2018 wurde Lenvatinib für die Behandlung des hepatozellulären Karzinoms zugelassen. Der Arzneistoff wird durch Eisai vermarktet.
Kosten
Die Jahrestherapiekosten liegen pro Patient bei rund 90.000 €.[3]
Nutzenbewertung
Der Zusatznutzen einer Therapie mit Lenvatinib wird vom G-BA auf der Basis der vom IQWiG ausgewerteten Studienergebnisse wie folgt eingeordnet:[3][4]
- Anhaltspunkt für einen geringen Zusatznutzen von Lenvatinib + Everolimus gegenüber der zweckmäßigen Vergleichstherapie Everolimus für Patienten mit fortgeschrittenem Nierenzellkarzinom
Quellen
- ↑ 1,0 1,1 1,2 1,3 Fachinformation Lenvima abgerufen am 29.07.2022
- ↑ 2,0 2,1 Fachinformation Kisplyx abgerufen am 29.07.2022
- ↑ 3,0 3,1 IQWiG-Berichte – Nr. 321 Lenvatinib –Bewertung gemäß § 35a Abs. 1 Satz 10 SGB V abgerufen am 01.10.2018
- ↑ Bewertung von Arzneimitteln für seltene Leiden nach § 35a Absatz 1 Satz 10 i.V.m.5. Kapitel § 12 Nr. 1 Satz 2 VerfO Wirkstoff: Lenvatinib abgerufen am 1.10.2018
Literatur
- Fachinformation Kisplyx®, abgerufen am 29.07.2022
- Fachinformation Lenvima®, abgerufen am 29.07.2022