MRSA
Eine neue Leitlinie ist verfügbar.
Klick auf "Bearbeiten" und aktualisiere diesen Artikel!
Eine neue Leitlinie ist verfügbar.
Klick auf "Bearbeiten" und aktualisiere diesen Artikel!
Abkürzung für: Methicillin-resistenter Staphylococcus aureus
Synonyme: Multiresistenter Staphylococcus aureus, Oxacillin-resistenter Staphylococcus aureus (ORSA)
Englisch: Methicillin-resistant Staphylococcus aureus
Definition
MRSA steht für Methicillin-resistenter Staphylococcus aureus - eine durch den breiten Einsatz von Antibiotika seit den 1960er Jahren zunehmend auftretende resistente Staphylokokkenart. In Kliniken und Pflegeeinrichtungen spielen MRSA als Verursacher von nosokomialen Infektionen eine wichtige Rolle.
Im klinischen Sprachgebrauch wird MRSA oft mit multiresistenter Staphylococcus aureus übersetzt. Fachlich gesehen ist das zwar nicht ganz korrekt, die allermeisten MRSA-Stämme sind aber nicht nur gegen Beta-Laktam-Antibiotika, sondern auch gegen andere Antibiotika-Gruppen resistent, also tatsächlich multiresistent.
siehe auch: Antibiotikaresistenz, Methicillin-sensibler Staphylococcus aureus
Hintergrund
Inzwischen gibt es MRSA-Varianten, die in der normalen Umgebung auftreten und nicht mit medizinischen Einrichtungen in Verbindung stehen.[1] Diese werden als "community acquired MRSA" (cMRSA oder CA-MRSA) bezeichnet. MRSA-Stämme, die in der Tierzucht eine Rolle spielen, heißen "Livestock-assoziierte MRSA" (LA-MRSA).[2] Der "normale" MRSA heißt in dieser Nomenklatur HA-MRSA (für "healthcare associated").
Während nosokomiale MRSA-Infektionen häufig als Komplikation bei anderweitig erkrankten oder immunsupprimierten Patienten auftreten, kommen bei den cMRSA Stämme vor, die zusätzliche Pathogenitätsfaktoren aufweisen und schwere Infektionen auch bei nicht Vorerkrankten hervorrufen können. Hierzu gehört insbesondere das Panton-Valentine-Leukozidin (PVL). In den USA wurden Ausbrüche mit solchen Stämmen z. B. bei Sportlern beobachtet, die zusammen duschten. Sie litten gehäuft an abszedierenden Hautinfekten (Furunkel).
Resistenzmechanismus
Die Beta-Laktam-Resistenz der MRSA-Stämme beruht auf der Bildung eines veränderten Penicillin-Bindungs-Proteins. Das mecA-Gen bildet hierfür fast immer die genetische Grundlage. Neuerdings wurden auch andere Resistenzgene identifiziert, unter anderem mecC. Die Stämme werden auf diese Weise resistent gegen alle Beta-Laktam-Antibiotika. Die Resistenztestung wurde früher mit Methicillin als Leitantibiotikum durchgeführt, woher sich auch die Bezeichnung "Methicillin-resistent" herleitet. Da zwischenzeitlich die Resistenz gegen Oxacillin getestet wurde, ist auch die Bezeichnung "Oxacillin-resistenter Staphylococcus aureus" (ORSA) im Umlauf. Heutzutage wird als Testsubstanz Cefoxitin verwendet (dies hat aber nicht dazu geführt, den Erreger "CRSA" zu nennen). Normalerweise wird ein auffälliges Cefoxitin-Screening durch eine Zweituntersuchung bestätigt (PBP2a-Test oder molekulargenetischer Nachweis des mecA-Gens).
Screening
Um eine MRSA-Besiedelung festzustellen, werden oberflächliche Abstriche mit einem Wattestäbchen an verschiedenen Stellen des Körpers genommen. Staphylokokken gehören zur transienten Hautflora mit Bevorzugung feuchter Bereiche. Übliche Lokalisationen für Abstriche sind daher die Nasenvorhöfe, der Rachen sowie Kathetereintrittsstellen und chronische Wunden. Weitere Probenentnahmen können in den Achselhöhlen, in der Leiste und perianal bzw. am Damm erfolgen; außerdem kommen die Stirn (Haaransatz), der Bereich hinter den Ohren und die vordere und hintere Schweißrinne in Frage. Die Proben werden im mikrobiologischen Labor mit geeigneten Screeningmethoden untersucht. Das konkrete Vorgehen sollte schriftlich festgelegt werden, etwa durch die Hygienekommission.
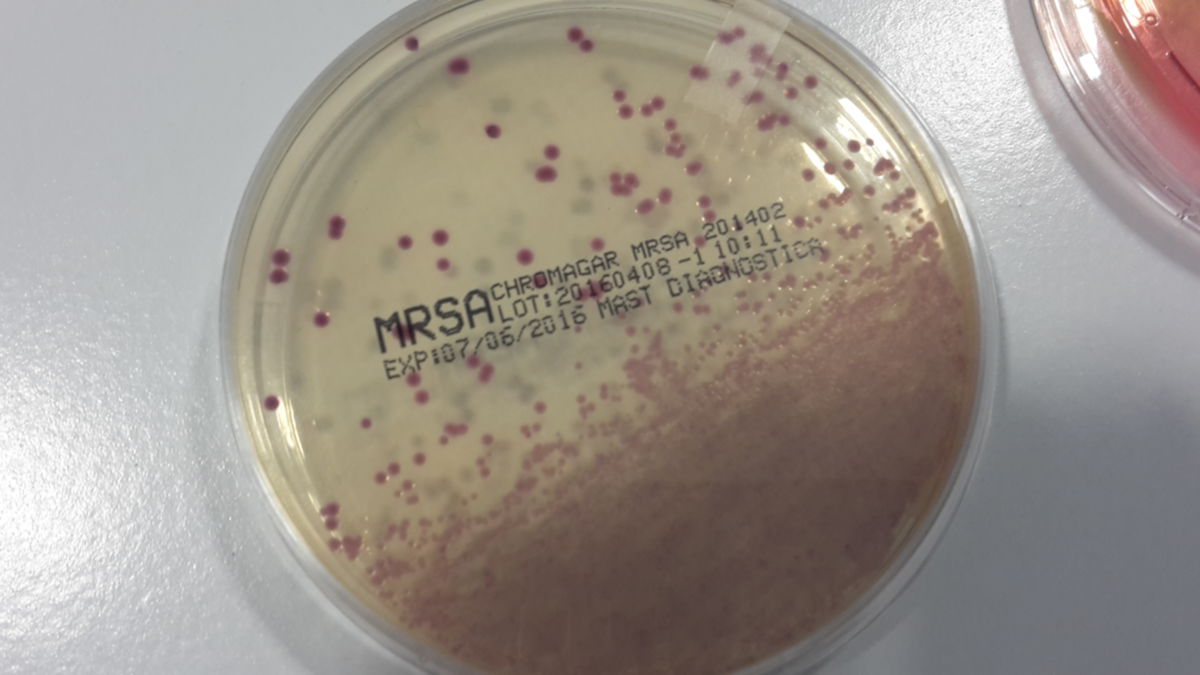
Die Abstriche werden in der Regel auf speziellen Agarplatten mit selektivem Differentialmedium, das Cefoxitin enthält, aufgebracht und bebrütet. Bei Vorhandensein von MRSA bilden sich rosa- bis lilafarbene Kolonien auf der Agarplatte.
Therapie und Hygienemaßnahmen
Eine MRSA-Infektion ist schwerer zu behandeln als eine Infektion mit sensiblen Keimen. Zum Einsatz kommen die Glykopeptid-Antibiotika Vancomycin und Teicoplanin, sowie neuere Präparate wie Linezolid, Daptomycin, Tigecyclin und die beiden Cephalosporine der 5. Generation Ceftarolin und Ceftobiprol. Gegen bestimmte MRSA-Stämme wirken auch Doxycyclin und Cotrimoxazol. Zudem werden betroffene Patienten isoliert.
Im Umgang mit MRSA ist besonderes Augenmerk auf die Einhaltung hygienischer Maßnahmen zu richten, da nur so eine weitere Ausbreitung innerhalb des Krankenhauses zu verhindern ist. Hauptübertragungsweg für MRSA sind Hände (siehe auch: Händedesinfektion). Der Anteil von MRSA-Trägern unter dem Krankenhauspersonal beträgt bis zu 30%.
In diesem Zusammenhang ist die Sanierung von nicht erkrankten (= latenten) MRSA-Trägern von großer Bedeutung. Zu diesem Zweck sind derzeit desinfizierende Ganzkörperbäder oder Ganzkörperwaschungen (incl. Haarpflege) mit antiseptischen, Octenidin-haltigen Waschlotionen üblich. Darüber hinaus kann die Applikation von topischen Antibiotika (z.B.Mupirocin) notwendig sein sowie die Anwendung antiseptischer Mundspüllösungen. Inwieweit diese Maßnahmen zur Eindämmung des Problems beitragen, ist umstritten. Bei Reihenuntersuchungen in den USA wurden mittlerweile MRSA in etwa 10% der Nasenabstriche von gesunden Kindern entdeckt.
Jüngere Forschungsergebnisse weisen darauf hin, dass die Verbreitung von MRSA durch bestimmte Amöbenarten (Acanthamoeba polyphagam) gefördert wird.[3] In diesen Einzellern können sich die Erreger sehr schnell vermehren.
Konkretes Vorgehen
- Schnelltest bei Risikopatienten (z.B. Unterbringung im Pflegeheim; Versorgung durch einen Pflegedienst; Krankenhausaufentalt im In- oder Ausland in der kürzeren Vergangenheit oder chronische Wunden)
- Umgehende Isolation des Patienten, wenn positiv
- Einzelzimmer mit Schleuse
- Schutzkittel für Personal und Besucher
- hygienische Händedesinfektion vor und nach Patientenkontakt
- Mundschutz und Einmalhandschuhe
- ggf. Haarschutz (je nach Krankenhausstandard)
- Einmalgeschirr
- Bereichspflege und keine Funktionspflege durch das Pflegepersonal, um die "Durchlaufrate" und die Keimverschleppung zu minimieren.
- 7 Tage täglich Wäschewechsel; Ganzkörperwäsche und Haarpflege mit antiseptischer Waschlotion; nasale Anwendung von Mupirocin und einer antiseptischen Mundspüllösung
- Tag 8-10 Nasenabstriche an jedem Tag. Wenn alle 3 Abstriche negativ sind, kann der Patient entisoliert werden. Wenn nicht, beginnt der Zyklus von vorne.
Besuche sollten auf ein Minimum reduziert werden und Besucher eine umfangreiche Aufklärung zum Thema MRSA sowie eine gründliche Hygieneeinweisung erhalten.
Differenzierung
Nasenabstrich positiv
Patienten, die in einem Krankenhaus positiv auf MRSA in der Nase getestet werden, müssen isoliert und alleine in einem Zimmer versorgt werden. Bei einem massiven Aufkommen von MRSA-positiven Patienten kann auch eine Kohortenisolation erfolgen. Dabei muss darauf geachtet werden, dass Patienten, die im gleichen Zimmer liegen, sich im gleichen Zyklus der Sanierung befinden.
Wundabstrich positiv
Bei MRSA-positivem Wundabstrich muss keine strikte Isolation erfolgen. Hier reicht es in der Regel, bei der Wundversorgung einen Einmalkittel und Handschuhe zu tragen.
Meldepflicht
Eine MRSA-Infektion ist meldepflichtig, wenn der Erreger in der Blutkultur oder im Liquor nachgewiesen wurde.
Quellen
- ↑ Deutsches Ärzteblatt
- ↑ Robert-Koch-Institut
- ↑ Huws, S. A., Smith, A. W., Enright, M. C., Wood, P. J. and Brown, M. R. W. (2006), Amoebae promote persistence of epidemic strains of MRSA Environmental Microbiology, 8: 1130–1133. doi: 10.1111/j.1462-2920.2006.00991.x