Cholesterinbiosynthese
Definition
Als Cholesterinbiosynthese wird der biochemische Prozess bezeichnet, über den im menschlichen Körper Cholesterin produziert wird.
Hintergrund
Cholesterin zählt zu den Isoprenlipiden und ist ein typisches Membranlipid tierischer Zellen, das für die Aufrechterhaltung der Membranfluidität wichtig ist. Weiterhin stellt Cholesterin die Vorstufe des Steroidhormone, der Gallensäuren und der Calciferole dar. Als Fettsäureester kann es intrazellulär gespeichert werden.
Die Cholesterinbiosynthese deckt ca. zwei Drittel des täglichen Cholesterinverlustes, während der Rest normalerweise mit der Nahrung tierischen Ursprungs aufgenommen wird. Täglich wird etwa 1 g Cholesterin in Form von Gallensäuren ausgeschieden. Ein kleiner Teil von nicht-modifiziertem Cholesterin gelangt mit der Galle in den Darm und wird zu Koprosterin umgewandelt und ausgeschieden. Die aus Cholesterin entstehenden Steroidhormone werden modifiziert über den Urin eliminiert.
Geschichtliches
Für die Untersuchungen der Cholesterinbiosynthese erhielten Konrad Bloch und Feodor Lynen 1964 den Nobelpreis für Medizin. Weiterhin erhielten Michael Brown und Josef Goldstein 1985 den Nobelpreis für Medizin für ihre Untersuchungen zur Regulation der endogenen Cholesterinsynthese und zur pathophysiologischen Rolle von Cholesterin bei der Entstehung der Arteriosklerose.
Biosynthese
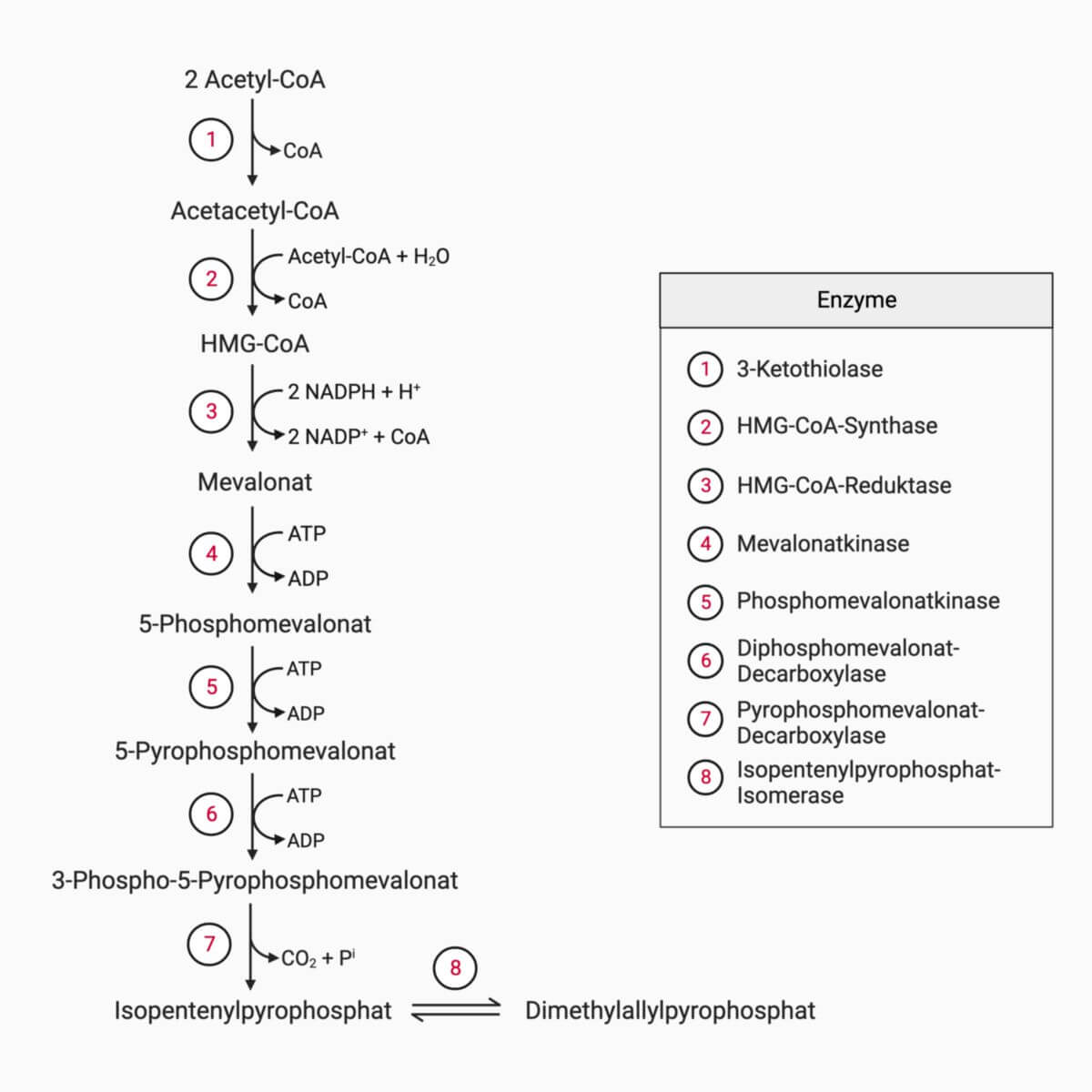
Die Cholesterinbiosynthese wird in vier Schritte eingeteilt:
- aus Acetyl-CoA entsteht Mevalonat (Mevalonatbiosyntheseweg)
- aus Mevalonat entsteht Isopentenylpyrophosphat ("aktives Isopren")
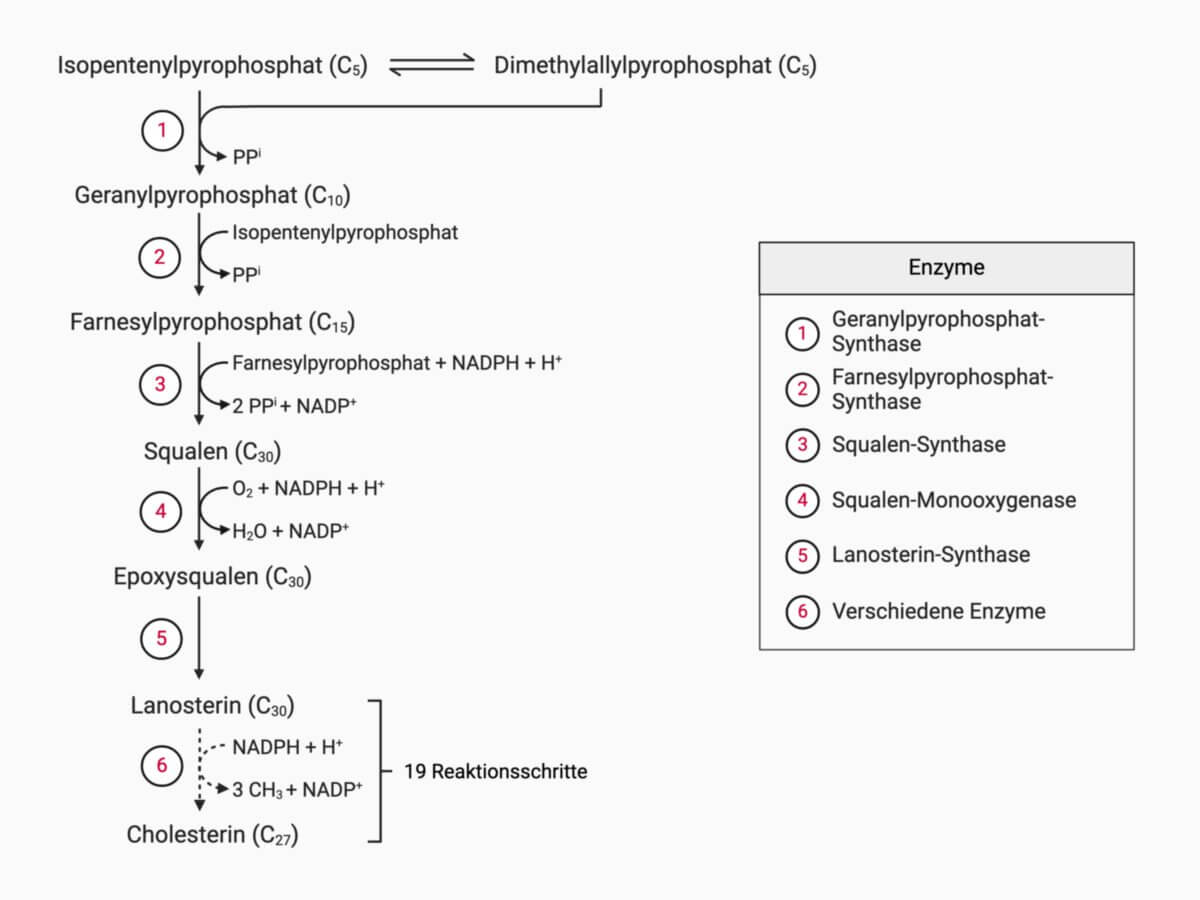
- Isopentenylpyrophosphat wird zu Squalen kondensiert
- Squalen zyklisiert zum Cholesterin
Bildung von Mevalonat
Zunächst kondensieren 2 Moleküle Acetyl-CoA unter Abspaltung von CoA-SH zu Acetoacetyl-CoA. Diese Reaktion wird durch die 3-Ketothiolase katalysiert. Anschließend lagert sich ein weiteres Acetyl-CoA an, sodass β-Hydroxy-β-Methylglutaryl-CoA (HMG-CoA) entsteht. Diese Reaktion gleicht der im Mitochondrium stattfindenden Biosynthese der Ketonkörper, findet jedoch im Zytosol statt. Das katalysierende Enzym ist die HMG-CoA-Synthase.
Im letzten und geschwindigkeitsbestimmenden Schritt wird durch die HMG-CoA-Reduktase HMG-CoA unter Verbrauch von 2 NADPH und Abspaltung von CoA-SH zu Mevalonat reduziert. Diese Reduktion erfolgt an der Carboxylgruppe von HMG-CoA, die den Thioester trägt.
Bildung von aktivem Isopren
Aus Mevalonat entsteht durch folgende Reaktionen das aktive Isopren Isopentenylpyrophosphat, das sich formal vom 2-Methyl-1,3-Butadien herleitet:
- Mevalonat wird durch zweimalige ATP-abhängige Phosphorylierung an der CH2OH-Gruppe über das Zwischenprodukt 5-Phosphomevalonat in 5-Pyrophosphomevalonat umgewandelt. Entsprechende Enzyme sind Mevalonatkinase und Phosphomevalonatkinase.
- Durch eine dritte ATP-abhängige Phosphorylierung kommt es zur Veresterung der Hydroxylgruppe am C3-Atom des Mevalonats, sodass 3-Phospho-5-Pyrophosphomevalonat entsteht.
- Die Pyrophosphomevalonat-Decarboxylase sorgt für eine Decarboxylierung und Dephosphorylierung, sodass Isopentenylpyrophosphat gebildet wird.
Isopentenylpyrophosphat ist nicht nur Ausgangsprodukt für die Cholesterinbiosynthese, sondern auch für die der Polyisoprene und Terpene.
Bildung von Squalen
Isopentenylpyrophosphat wird durch die Isopentenylpyrophosphatisomerase zu Dimethylallylpyrophosphat isomerisiert. Anschließend folgt eine Kopf-Schwanz-Kondensation:
- Abspaltung von Pyrophosphat, sodass ein Carbenium-Ion entsteht.
- An das Carbeniumion kondensiert ein weiteres Isopentenylpyrophosphat-Molekül, sodass ein neues Carbokation gebildet wird, aus dem durch Abspaltung eines Protons Geranylpyrophosphat entsteht. Die Reaktion wird durch das Enzym Geranylpyrophosphat-Synthase katalysiert, das zu den Prenyltransferasen gehört.
- Nach einem gleichartigen Mechanismus katalysiert die Farnesylpyrophosphat-Synthase die Kondensation von Geranylpyropsohpat mit Isopentenylpyrophosphat. Es entsteht das aus 15 C-Atomen bestehende Farnesylpyrophosphat.
Zwei Moleküle Farnesylpyrophosphat kondensieren unter Katalyse der Squalensynthase zum aus 30 C-Atomen bestehenden Squalen. Bei dieser Kopf-Kopf-Kondensation tritt ebenfalls nach Pyrophosphateliminierung ein Carbokation als Zwischenprodukt auf. Außerdem wird das Zwischenprodukt Präsqualenpyrophosphat NADPH-abhängig reduziert.
Synthese von Cholesterin
In einer zweistufigen Reaktion entsteht unter Ringschluss aus Squalen (S)-2,3-Epoxysqualen und schließlich Lanosterin. Hierbei wandert jeweils eine Methylgruppe auf das C13- und C14-Atom.
Lanosterin wird durch Demethylierung zu 4,4-Dimethyl-5α-cholesta-8,14,24-trien-3β-ol. In einigen Oxidationsreaktionen entsteht daraus 14-Demethyllanosterin, das über Zymosterincarboxylat zu Zymosteron umgesetzt wird. Zymosteron wird zu Zymosterin reduziert. Über 5α-Cholesta-7,24-dien-3β-ol entsteht schließlich 7-Dehydrocholesterin, das durch Hydrierung zu Cholesterin wird.
Regulation
Der Körper kann die Cholesterinbiosynthese je nach Bedarf und Nahrungsaufnahme regulieren. Durch Verminderung der Cholesterinaufnahme lässt sich auch der Cholesterinspiegel im Plasma senken und umgekehrt.
Die Cholesterinbiosynthese wird auf folgenden Ebenen reguliert:
Downregulation
Cholesterin hemmt die Aktivierung von SREBP-2. Dieser Transkriptionsfaktor bindet physiologischerweise an einen Enhancer, das Sterolregulationselement 1 (SRE 1), und induziert dadurch die Transkription der HMG-CoA-Reduktase sowie anderer Enzyme der Cholesterinsynthese. Somit hemmt Cholesterin seine eigene Synthese.
SREBPs sind auch an der Regulation der Fettsäure- und Triglyceridsynthese, der Aufnahme von Cholesterin und Fettsäuren in die Zellen sowie am Glucosestoffwechsel beteiligt.
Abbau der HMG-CoA-Reduktase
Cholesterin verkürzt die Halbwertszeit der HMG-CoA-Reduktase: Cholesterin und andere Sterole (v.a. Oxysterole) binden allosterisch an die HMG-CoA-Reduktase und lösen eine Ubiquitinierung und somit einen Abbau des Enzyms aus.
Inaktivierung der HMG-CoA-Reduktase
Die HMG-CoA-Reduktase wird durch reversible Phosphorylierung inaktiviert: Diese Reaktion erfolgt durch die AMP-abhängige Kinase. AMP fällt dann an, wenn in Zellen ein Energiemangel herrscht. Eine Proteinphosphatase kann den Effekt rückgängig machen.
Schilddrüsenhormone und Insulin stimulieren die Dephosphorylierung, Glukagon durch Veränderungen des cAMP-Spiegels die Phosphorylierung.
Bildungsorte
Etwa 80 % der Biosynthese wird von der Leber übernommen, der Rest findet im Verdauungstrakt, in der Nebennierenrinde und in den Reproduktionsorganen statt.
Der erste Teil der Cholesterinbildung (vom Acetyl-CoA bis zur Entstehung des Mevalonat) spielt sich im Zytosol ab, die nächsten Schritte in Peroxisomen und im Zytosol. Mit der Entstehung von Squalen verlagert sich die Synthese in das endoplasmatische Retikulum der Zellen.
Klinik
Eine verminderte Aktivität der HMG-CoA-Reduktase findet sich bei Nahrungskarenz sowie bei Diabetes mellitus. Bei letzterem können die Cholesterinspiegel im Blut jedoch erhöht sein, da vermutlich der Umsatz und die Ausscheidung von Cholesterin verlangsamt sind. Eine ähnliche Konstellation findet man bei einer Hypothyreose. Bei der Hyperthyreose ist die Aktivität der HMG-CoA-Reduktase erhöht. Die Cholesterinspiegel sind jedoch erniedrigt, da der Umsatz und die Ausscheidung gesteigert sind.
Gallensäuren hemmen die Cholesterinsynthese. Wird die Rückresorption der Gallensäuren im Darm durch Gabe von Colestyramin unterbunden, steigt die Cholesterinbiosynthese in der Leber. Gleichzeitig ist die Gallensäureneubildung aus Cholesterin erhöht, sodass der Serumcholesterinspiegel absinkt.
Bestimmte Pilzmetabolite wie Mevinolin oder Compactin wirken als kompetitive Inhibitoren der HMG-CoA-Reduktase. Statine, Derivate dieser Pilzmetabolite, werden bei Hypercholesterinämien eingesetzt, sofern eine Ernährungsumstellung nicht ausreicht. Auch Phytosterine aus pflanzlicher Nahrung können die endogene Cholesterinbiosynthese hemmen.
Podcast

Quellen
- Horn F: Biochemie des Menschen. 6. Auflage, 2015. Thieme Verlag. DOI: 10.1055/b-0035-126217
Bildquelle
- Bildquelle Podcast: ChatGPT (DocCheck)