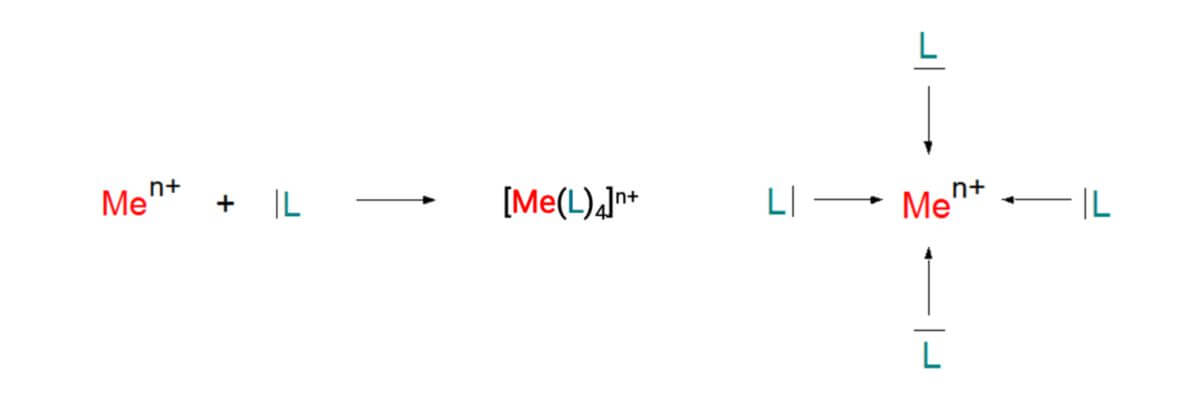Metallkomplex
von lateinisch: complexum - umgeben, umklammert
Englisch: metal complex
Definition
Ein Metallkomplex ist eine Struktur, die ein Zentralatom in Form eines Metallions besitzt. Dieses weist in seiner Elektronenkonfiguration Lücken auf und ist deshalb von einem oder mehreren Molekülen oder Ionen (den Liganden) umgeben, die jeweils mindestens ein freies Elektronenpaar für eine koordinative Bindung zur Verfügung stellen.
Koordinative Bindung
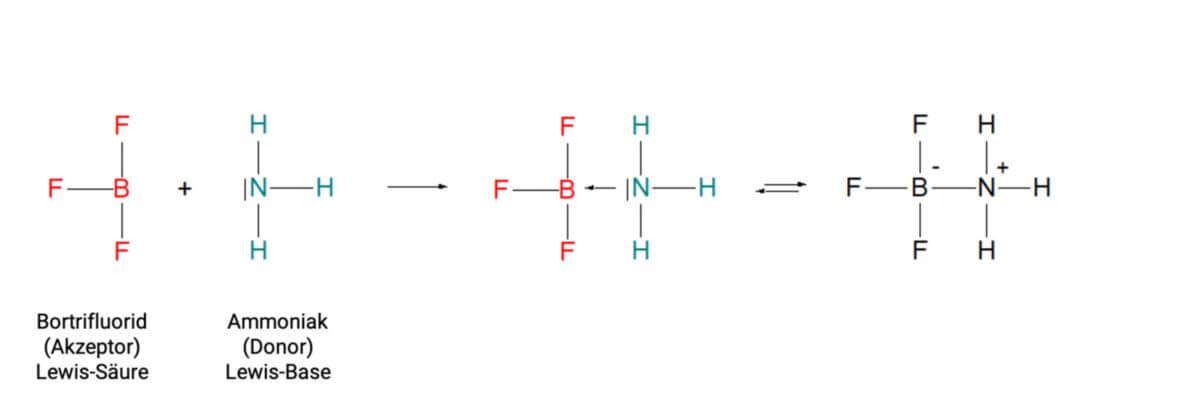
Eine koordinative Bindung ist eine spezielle Bindung der Komplexchemie. Bei dieser Bindung stammen die Bindungselektronen der Elektronenpaarbindung nur von einem der beiden Bindungspartner. Dabei bezeichnet man das Molekül oder Ion mit Elektronenmangel als Akzeptor bzw. Lewis-Säure, dasjenige mit den freien Elektronen als Donator bzw. Lewis-Base. Eine koordinative Bindung wird in der neueren Literatur wie jede andere kovalente Bindung als Linie dargestellt. In älteren Büchern taucht sie als Pfeil in Richtung auf den Akzeptor auf.
Um Metallkomplexe beschreiben zu können, wird das Lewis-Konzept angewendet. Im Zentrum enthalten Metallkomplexe ein Metallkation (Zentralion) und darum herum eine unterschiedliche Anzahl von Molekülen und/oder Anionen, die sogenannten Liganden. Das Zentralion dient dabei als Akzeptor bzw. Lewis-Säure. Die Liganden stellen – da sie freie Elektronenpaare besitzen – als Donatoren bzw. Lewis-Basen die Elektronen zur Verfügung.
| Bei einer koordinativen Bindung stammen beide Bindungselektronen vom Liganden. |
|---|
Die eckige Klammer in der obigen Grafik dokumentiert, dass der Metallkomplex in diesem Beispiel aus vier ungeladenen Ligandenmolekülen (blaues "L") und einem Zentralion (rotes "Me") besteht. Der daraus resultierende Metallkomplex ist ein Kation. Seine Ladung muss daher durch Anionen in der Lösung ausgeglichen werden.
Aufbau
Metallionen sind als Akzeptoren zur Komplexbildung befähigt. Von der Stellung des Metalls im Periodensystem hängt ab, wie ausgeprägt die Tendenz zu einer solchen Bildung ist – ebenfalls hängt davon die Stabilität des Komplexes ab. Die Elektronenkonfiguration des jeweiligen Metallions und die Elektronenpaar-Donatorfähigkeit des Liganden bestimmen somit die Komplexbildung wesentlich. Kationen von Nebengruppenelementen sind besonders gute Akzeptoren, da sie häufig Elektronenlücken in der äußersten sowie in einer inneren Elektronenschale aufweisen. Beispielsweise sind das in der 4. Periode unbesetzte 3d-Orbital. Folgende Metallionen gehören dazu:
Liganden
Als Liganden kommen Anionen oder solche Moleküle in Frage, die über ein freies Elektronenpaar verfügen. Einige Beispiele sind in der folgenden Tabelle aufgelistet. Den Liganden liegen Nichtmetalle zugrunde. Dies ist auch der Grund, wieso auch organische Moleküle Liganden sein können, sofern sie zum Beispiel einen polaren Rest mit einem Stickstoff-, Sauerstoff- oder Schwefelatom enthalten. Die koordinative Bindung geht bei größeren Molekülen von dem Atom aus, welches sich als stärkster Elektronendonator gegenüber dem Zentralion erweist. Betrachtet man die Liganden Cyanid und Kohlenmonoxid, erkennt man, dass die koordinative Bindung, die einer σ-Bindung ähnelt, durch Anteile einer π-Bindung ergänzt, deren Elektron vom Zentralion stammen. Das ist somit auch die Erklärung, wieso diese Liganden besonders stark an Übergangsmetallionen wie Fe2+/Fe3+ gebunden werden und deshalb eine Sonderstellung einnehmen.
| Anionen: | Fluorid (F-) Chlorid (Cl-) Iodid (I-) Hydroxid (OH-) |
Cyanid (CN-) Thiocyanat (CNS-) Thiolat (R—S-) Carboxylat (R—COO-) |
| Moleküle: | Ammoniak (NH3) Amin (R—NH2) Stickstoffmonoxid (NO) Kohlenmonoxid (CO) |
Sauerstoff (O2) Wasser (H2O) Alkohol (R—OH) Ether (R1—O—R2) |
Koordinationszahl
Als Koordinationszahl wird die Zahl der Liganden-Bindungsplätze am Zentralion bezeichnet. Sie hängt unter anderem von der Größe der Liganden sowie von der Elektronenkonfiguration des Zentralions ab. Bekannt sind Metallkomplexe mit Koordinationszahlen von 2 bis 12. Die am häufigsten vorkommenden Koordinationszahlen sind 2, 4 und 6. Diese Zahl steht aber in keinem Zusammenhang mit der Ladung des Zentralions.
Treten ein Zentralion und eine bestimmte Anzahl an Liganden zusammen, so entsteht ein definierter Komplex, der sich in seinen Eigenschaften von denen der einzelnen Bausteine unterscheidet. Dieser Unterschied kann sich zum Beispiel in der Farbe widerspiegeln oder auch darin, dass sich die Bestandteile zuweilen nicht mehr direkt nachweisen lassen. Der Metallkomplex wird in eckigen Klammern angegeben. Man muss jedoch beachten, dass diese eckigen Klammern in diesem Fall nicht als Kennzeichnung einer Konzentration dienen, wie man es aus der Hydroniumionen-Konzentration [H3O+] kennt.
Gesamtladung
Will man die Gesamtladung eines Metallkomplexes herausfinden, so setzt sich diese aus den Ladungen der Bausteine zusammen. Weisen die Liganden Neutralität auf, so entspricht die Gesamtladung der positiven Ladung des Zentralions. Sind die Liganden Anionen, so können deren Ladung die des Zentralions kompensieren oder gar übertreffen. Dies ist auch der Grund, wieso es auch ungeladene Komplexe oder Komplex-Anionen gibt. Letztere bilden zusammen mit Kationen Salze. Im folgenden Beispiel sind die verschiedenen Metallkomplexe aufgeführt, die Eisen(II)- oder Eisen(III)-salze mit Kaliumcyanid bilden.
| K4[Fe(CN)6] = Kaliumhexacyanoferrat(II) (gelbes Blutlaugensalz) |
| K3[Fe(CN)6] = Kaliumhexacyanoferrat(III) (rotes Blutlaugensalz) |
Nomenklatur
Die systematische Benennung von Metallkomplexen im Detail sprengt den Rahmen des Wissens, das für die Medizin notwendig ist. Deshalb werden hier nur einige Beispiele genannt. Bei den Bezeichnungen für die Liganden sind internationale Formulierungen verwendet worden.
- Enthält der Komplex ein Metallion als Baustein, werden zuerst die Liganden in alphabetischer Reihenfolge genannt.
- Um die Anzahl der Liganden zu dokumentieren, werden vorangestellte griechische Zahlenwörter verwendet, also "di" (zwei), "tetra" (vier) oder "hexa" (sechs).
- Sind anionische Liganden vorhanden, so tragen sie folgende Bezeichungen: Chlorido (Cl-), Hydroxido (OH-), Cyanido (CN-), Thiocyanido (NCS-), usw.
- Sind neutrale Liganden vorhanden, so tragen diese folgende Namen: "Aqua" (H2O), "Amin" (NH3), "Carbonyl" (CO) und "Nitrosyl" (NO).
- Am Ende der Metallkomplexbezeichnung steht der Metallname und dahinter in Klammern die Wertigkeit des Kations als römische Zahl.
- Ist der Komplex ein Anion, so erhält er die Endsilbe "-at" und das Metall erhält den lateinischen Namen mit nachgestellter Wertigkeit. Zum Beispiel: "-ferrat(II)".
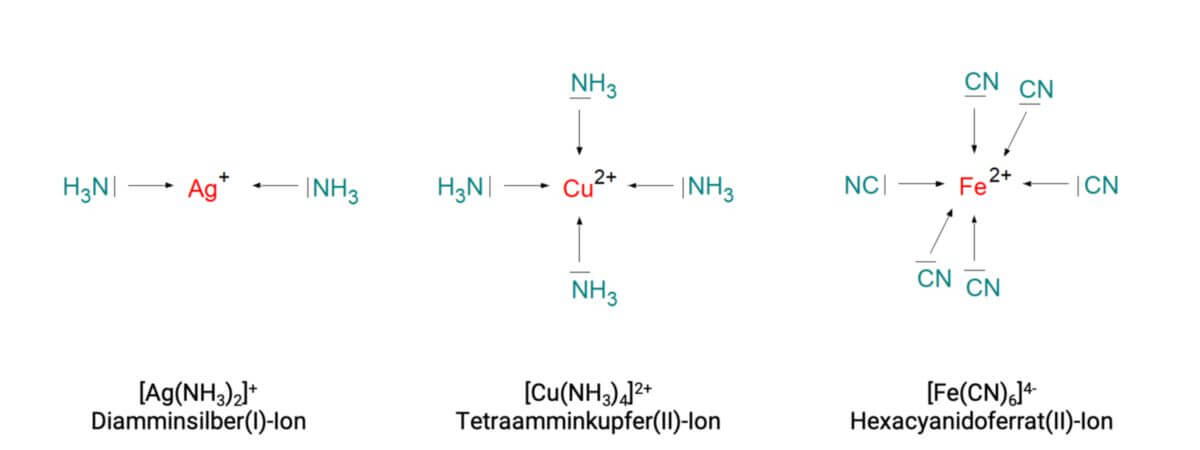
- Je nachdem, welche Gesamtladung der Metallkomplex aufweist, wird das zugehörige Anion dem Komplexnamen nachgestellt. Beispiel: Diamminsilber(I)-chlorid, das Kation jedoch vorangestellt, z.B. Kaliumhexacyanidoferrat(II).
Chelatkomplexe
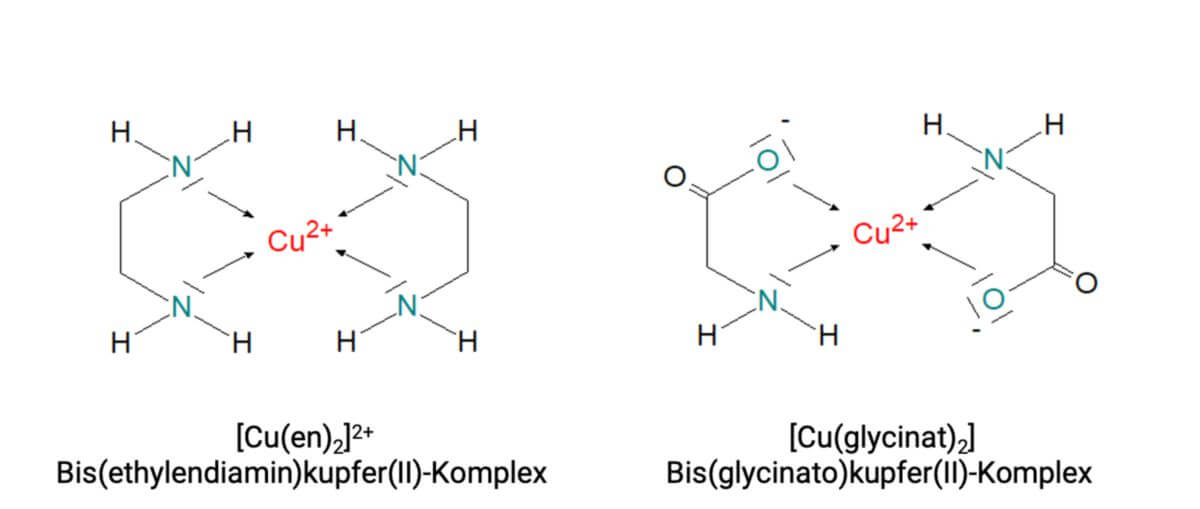
In den oben genannten Beispielen hatte jeder Ligand nur ein Donator-Atom. Es gibt natürlich auch organische Moleküle, die mehrere Donator-Atome in ihrer Struktur aufweisen und mit diesen an dasselbe Zentralion herantreten können. Ein solcher Ligand ist dann "mehrzähnig" und heißt Chelator (griech. chele = Krebsschere). Das daraus entstehende Teilchen ist ein Chelatkomplex. Folgendes Beispiel soll zeigen, dass ein Zentralion mit der Koordinationszahl 4 z.B. zwei zweizähnige Chelatoren (links) oder einen vierzähnigen Chelator (rechts) binden kann. Letzteres zeigt deutlich, dass das Metallion vom Chelator weitgehend eingehüllt wird.
Zu den zweizähnigen Chelatoren zählen zum Beispiel Ethylendiamin (Abkürzung "en") oder das Anion (Glycinat) der Aminosäure Glycin. Gemeinsam mit Cu2+ bilden sie die folgenden Chelatkomplexe, deren Gesamtladung im ersten Beispiel +2 und im zweiten 0 beträgt.
Günstig für die Bildung eines Chelatkomplexes ist der Abstand der Donator-Atome in einem Chelator dann, wenn der Ring, den das Zentralon mit dem Chelator bildet, 5- oder 6-gliedrig wird. Diese Ringe sind nicht gespannt und damit energetisch bevorzugt. In beiden Beispielen liegen 5-gliedrige Ringe vor.
Bezug zur Medizin
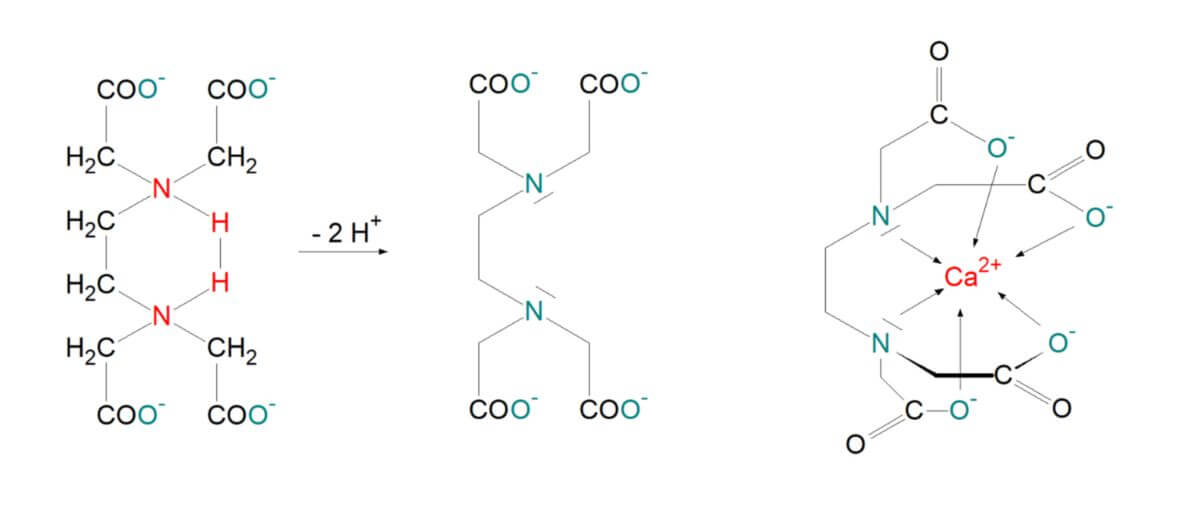
In der Medizin wird häufig EDTA (Ethyldiamintetraacetat) als Chelator für zweiwertige Metallionen in wässriger Lösung verwendet. Es wird als Dinatriumsalz eingesetzt. Bei einem pH-Wert von 7 liegt es als Dianion vor (EDTA2-). Unter dem Einfluss des Metallions geht EDTA2- unter der Abgabe von zwei Protonen in das Tetraanion (EDTA4-) über. Dieses Tetraanion ist ein sechszähniger Chelator. Mit Ca2+ zusammen bildet das EDTA4- einen Chelatkomplex, dessen Gesamtladung -2 beträgt. Die freigesetzten Protonen verschieben den pH-Wert der Lösung in den sauren Bereich und wirken somit der Komplexbildung entgegen. Damit die Metallionen vollständig mit EDTA komplexieren, wird eine schwach alkalische Pufferlösung verwendet.
Reaktionen
Ligandenaustausch-Reaktionen
Metallionen in wässriger Lösung liegen hydratisiert vor. Es tritt zwischen dem Kation und den Wassermolekülen eine Ion-Dipol-Wechselwirkung auf. Bei vielen Metallionen (besonders bei Erdalkali- und Übergangsmetalle) kann man die Wassermoleküle aufgrund eines Anteils an koordinativer Bindung auch als Liganden ansehen. Dementsprechend kann man sie als Aquakomplexe formulieren. Diese genannten Aquakomplexe sind hydratisierte Metallionen mit einer festgelegten Anzahl von Wassermolekülen in der ersten Hydratationssphäre (Hydratation).
| Aquakomplexe: | [Co(H2O]6]2+ | [Cu(H2O)4]2+ | [Fe(H2O)6]3+ |
Lässt man ein Metallion in einer wässrigen Lösung [Me(H2O)x]n+ mit geeigneten Liganden reagieren, werden in den Aquakomplexen die Wasser-Liganden ganz oder teilweise gegen andere Liganden (L) ausgetauscht. Dieser Ligandenaustausch ist bei viele Metallionen der Übergangsmetalle mit einer auffälligen Farbänderung verbunden.
| Allgemeine Reaktionsgleichung: |
|---|
Beispiele (Metallkomplex-Reaktion)
| [Cu(H2O)4]2+ = blassblau [Cu(NH3)4]2+ = tiefblaues Tetramminkupfer(II)-Ion |
| [Fe(H2O)6]3+ = gelb [Fe(H2O)4(SCN)2]+ = rotes Tetraaquadithiocyanatoeisen(III)-Ion |
Alle Metallkomplexe (auch die Aquakomplexe) sind in wässriger Lösung zusätzlich hydratisiert. Im Umfeld der Kationen kann man koordinativ gebundene Wassermoleküle und Hydratwasser unterscheiden. Betrachtet man beispielsweise blaues Kupfer(II)-sulfat (CuSO4 · 5 H2O) oder grünes Eisen(II)-sulfat (FeSO4 · 7 H2O), so enthalten diese 4 bzw. 6 koordinierte Wassermoleküle und ein zusätzliches sogenanntes Hydratwasser, wenn sie auskristallisieren.
Reaktionen von Chelatoren mit Metallionen sind ebenfalls Ligandenaustausch-Reaktionen. Der Chelator EDTA4- setzt dabei 6 Moleküle eines anderen Liganden (hier Wasser) frei:
Stabilität von Metallkomplexen
Da Reaktionen, die zu Metallkomplexen führen, Gleichgewichtsreaktionen sind, lässt sich auch hier das Massenwirkungsgesetz anwenden. Hierbei unterscheidet man die Bildungskonstante Kf und die Zerfallskonstante Kd (Kd = 1 ÷ Kf) ("f" steht für engl. formation, "d" für engl. dissoziation). Aus Gründen der Übersicht werden die folgenden Gleichgewichte ohne die Einbeziehung von Wassermolekülen angegeben.
| Cu2+ + 4 NH3 ⇌ [Cu(NH3)4]2+ | Kf = {[Cu(NH3)4]2+} ÷ [Cu2+] [NH3]4 = 0,2 · 1014 |
| [Cu(NH3)4]2+ = Tetramminkupfer(II)-Ion | |
| Fe2+ + 6 CN- ⇌ [Fe(CN)6]4- | Kf = {[Fe(CN)6]4-} ÷ [Fe2+] [CN-]6 = 1033 |
| [Fe(CN)6]4- = Hexacyanoferrat(II)-Ion |
Labile und inerte Komplexe
Die Größe der Gleichgewichtskonstante zeigt an, dass in ammoniakalischer Lösung eine große Tendenz besteht, den Tetramminkupfer(II)-Komplex zu bilden. Dieser Komplex ist thermodynamisch gesehen stabil, das heißt, dass nur wenig vom Tetraaquakupfer(II)-Ion im Gleichgewicht vorliegt. Säuert man jedoch die Lösung des Tetramminkupfer(II)-Komplexes mit beispielsweise Schwefelsäure (H2SO4) an, so wird das NH3 unter der Bildung von NH4+ aus dem Gleichgewicht entfernt. Der Kupferkomplex zerfällt somit wieder (Rückreaktion) und wird thermodynamisch instabil. Selbiges geschieht bei einer Zugabe von Na2S. Hier jedoch wird das wenig vorhandene Cu2+ aus dem Gleichgewicht entfernt. Grund dafür ist, dass sich schwer lösliches CuS (L = 10-36 mol2/L2) bildet. Man beobachtet jedoch, dass sich in beiden Fällen rasch ein neues Gleichgewicht einstellt. Insgesamt wird dieser Komplex als stabil eingestuft. Das heißt, je nach Kf bzw. Kd tauschen sich die Liganden am Zentralion rasch in der einen oder anderen Richtung aus gemäß den jeweiligen Gleichgewichtskonstanten.
Bei der Komplexbildung von Fe2+ mit Cyanid liegt die Gleichgewichtskonstante weit auf der rechten Seite. Unterschied zum vorigen Beispiel ist jedoch, dass hier der Eisenkomplex beim Ansäuern oder der Sulfid-Zugabe nicht wieder zerfällt. Grund dafür ist jedoch nicht die Zerfallskonstante Kd (diese sollte wie vorher den Kupferkomplex den Zerfall thermodynamisch begünstigen, FeS: L = 10-19), sondern die Tatsache, dass dieser Eisenkomplex nur sehr, sehr langsam zerfällt. Metallkomplexe mit diesen Eigenschaften bezeichnet mal als kinetisch stabil oder auch als inert. Ein weiteres Beispiel zeigt folgende Reaktion:
| [Co(NH3)6]3+ + 6 H3O+ ⇌ [Co(H2O)6]3+ + 6 NH4+ | Kd = 1022 |
| Hexammincobalt(III)-Ion |
Solche inerte Metallkomplexe stellen eher die Ausnahme dar und sind deshalb nur für einige Metallionen typisch (z.B. Co3+ und Cr3+). Bei vielen Komplexreaktionen kann man beobachten, dass sich bei einem Ligandenaustausch sofort ein Gleichgewicht einstellt. Somit reicht die Kenntnis der Bildungskonstante Kf aus, um vorhersagen zu können, welcher Komplex bevorzugt entsteht, wenn verschiedene Liganden um eine Metallion konkurrieren. Dabei wird ein Begriff verwendet - "Stabilität eines Komplexes", welche eine thermodynamische Größe darstellt. Ist ein Metallkomplex stabiler als ein anderes, so bedeutet das, dass seine Bildungskonstante Kf im Vergleich größer ist, bzw. die Zerfallskonstante Kd kleiner.
Metallkomplexe sind einzigartig
Hat man geeignete Bedingungen, so lassen sich aus jedem Metallkomplex die Bausteine (Metallion oder Ligand) wieder "befreien", sprich: unverändert zurückgewinnen. Metallkomplexe weisen andere Eigenschaften auf als ihre einzelnen Bausteine. Diese Tatsache ist für eine chemische Reaktion typisch. Im Gegensatz zu anderen Reaktionen und Bindungen werden die Moleküle in einem Metallkomplex zwar neu angeordnet sind, jedoch als solche wenig verändert. Der Metallkomplex besteht als System also nur vorübergehend und löst sich z.B. bei einer Änderung des pH-Wertes wieder auf. Dies ist der Grund, wieso auch ein deutlicher Unterschied zur typischen kovalenten Bindung besteht, deren Bildung und Spaltung meist durch Enzyme katalysiert werden.
Chelat-Effekt
Da Chelatkomplexe eine größere Bildungskonstante aufweisen, als Komplexe mit einzähnigen Liganden, sind sie dadurch stabiler. Zurückzuführen ist diese Tatsache auf die Entropiezunahme (ΔS > 0) bei einer Komplexbildung mit einem Chelator. Diese Zunahme wird als "Chelat-Effekt" bezeichnet.
| [Ni(H2O)6]2+ + 6 NH3 → [Ni(NH3)6]2+ + 6 H2O | Kf = 2 · 109 |
| [Ni(H2O)6]2+ + 3 en → [Ni(en)3]2+ + 6 H2O | Kf = 3,8 · 1017 |
Geht man vom Hexaaquakomplex aus, so werden hier im ersten Beispiel sechs gleichartige Ligandenmoleküle gegeneinander ausgetauscht, weil Ammoniak (NH3) für Ni2+ ein besserer Ligand ist als Wasser. Dabei ändert sich am Ordnungszustand des Systems wenig. Betrachtet man das zweite Beispiel, so sieht man, dass sechs Wassermoleküle frei werden und drei Ethyldiamin-Moleküle gebunden werden. Stickstoffatome und ihre freien Elektronenpaare binden besser als Wasser an Ni2+. Außerdem fällt ins Gewicht, dass die Zahl der frei beweglichen Teilchen und damit die Unordnung (Entropie) des Systems zunimmt. Bei einer Entropiezunahme (ΔS0 positiv) wird eine Reaktion stärker exergon, da die Gibbs-Energie (ΔG0), die eine Auskunft über die Triebkraft gibt, einen Entropieterm hat. Eine größere Triebkraft ist gleichwertig zu einer Verschiebung des Gleichgewichts nach rechts. In beiden Fällen ist die Reaktionsenthalpie (ΔH0) in etwa gleich.
| ΔG0 = ΔH0 - T · ΔS0 | ΔG0 = - RT · ln Kf | (Kf = Bildungskonstante) |
|---|
Je mehr Donator-Atome ein Chelator hat, desto größer wird der Chelat-Effekt. Dies ist die Erklärung dafür, wieso so viele EDTA-Komplexe eine hohe Stabilität aufweisen, denn der Chelator EDTA4- hat sechs Donator Atome, die sechs Koordinationsstellen am Metallion besetzen. Somit verdrängt also ein EDTA4- sechs Wassermoleküle aus der Hydrathülle von Ca2+.
Eigenschaften
Farbe
Viele Metallionen der Übergangsmetalle, die in Wasser als Aquakomplex vorliegen, verändern nach einem Ligandenaustausch ihre Farbe. Da die Liganden mit ihren freien Elektronenpaaren freie Orbitale des Zentralions besetzen, gruppieren sich die bindenden und antibindenden Molekülorbitale energetisch neu. Die resultierende Farbe hängt mit der Energie zusammen, die benötigt wird, um Elektronen anzuregen. Bei der Anregung werden Elektronen vorübergehend in höher liegende, unbesetzte Molekülorbitale angehoben. Die Energiedifferenz entspricht dabei einem bestimmten Wellenlängenbereich der elektromagnetischen Strahlung (Licht). Aufgrund des Ligandenaustausches verschiebt sich bei den Übergangsmetall-Kationen die Wellenlänge für die Anregung in den sichtbaren Bereich des Lichtspektrums. Die Farbe kann sich somit verändern: zum Beispiel von gelb nach rot wie es beim Fe3+ der Fall ist. Ein weiteres Beispiel ist Cu2+, welches in wässriger Lösung blassblau ist. Gibt man Ammoniak hinzu, entsteht der tiefblaue Tetramminkupfer(II)-Komplex.
Löslichkeit
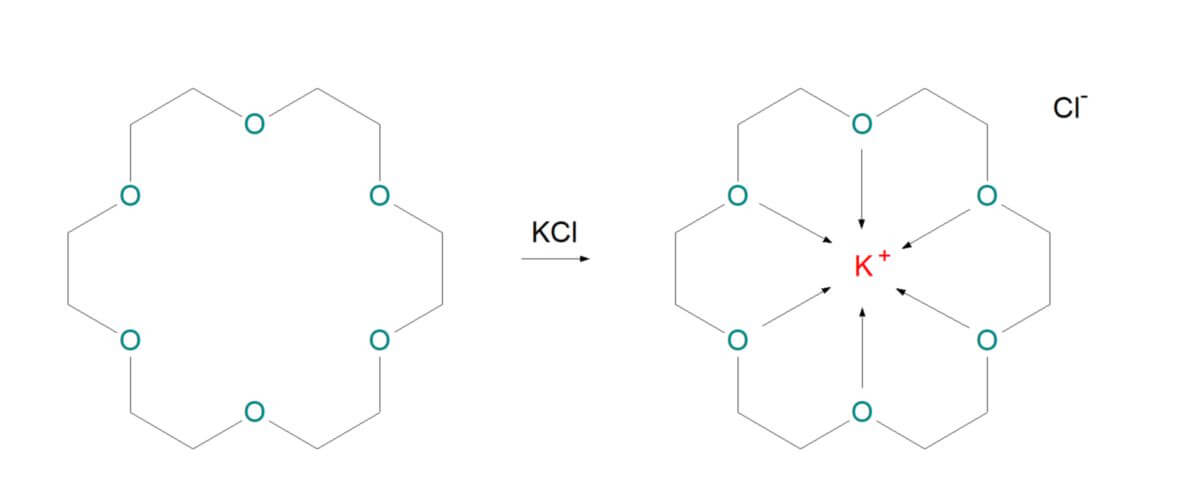
Die Komplexbildung verleiht dem Zentralion eine Hülle, durch die sich der Teilchenradius gegenüber dem "nackten" Ion vergrößert. Die Hülle beeinflusst u.a. die Löslichkeit und Wanderungsgeschwindigkeit des Zentralions bei der Diffusion. Manche Liganden oder Chelatoren sind so groß sind, dass die Löslichkeitseigenschaften des Zentralions vollständig maskiert werden und sie mit ihren eigenen Eigenschaften dominieren. Ein Beispiel hierfür sind Kronenether, die dafür sorgen, dass Alkalisalze sich in unpolaren organischen Lösungsmitteln (z.B. Chloroform oder Benzol) besser lösen als in Wasser. Dabei wird das Kation K+ vom Chelator eingehüllt, geht anschließend in die organische Phase über und zieht dabei das Anion Cl- zum Ladungsausgleich mit. Somit besitzen beide Ionen keine Hydrathülle mehr. Die Ladung des Zentralions wird durch Anionen-Liganden in Metallkomplexen überdeckt. Diese Tatsache ist ein weiterer Faktor, der die Löslichkeit beeinflusst, insbesondere dann, wenn die Gesamtladung des Komplexes null beträgt. Dies ist zum Beispiel beim Bis(glycinato)kupfer(II)-Komplex der Fall, der sich weniger gut in Wasser löst, als die Bausteine Cuaq2+ und Glycin.
Redoxpotential
Das Redoxpotential kann sich durch die Komplexbildung ebenfalls verändern. In wässriger Lösung hat das Co2+-Ion im Hexaaquakomplex ein Redoxpotential von + 1,81 V. Bei Zugabe von Ammoniak bildet sich ein Hexamminchobalt(II)-Komplex dessen Redoxpotential + 0,11 V beträgt. Durch die Abnahme des Redoxpotentials kann der Komplex leicht durch Luftsauerstoff (E0 = + 1,23 V) zum Hexammincobalt(III)-Komplex oxidiert wird. Vereinfacht ausgedrückt: Cobalt ist in wässriger Lösung in Gegenwart von Luftsauerstoff zweiwertig (Co2+), in Gegenwart geeigneter Liganden wie beispielsweise Ammoniak wird es jedoch zum Co3+ oxidiert.
| E0 = + 0,11 V | |
| E0 = + 1,23 V | |
| E0 = + 1,81 V | |
Metall- und Chelatkomplexe beim Menschen
Die Ionen biochemisch wichtiger Übergangsmetalle (Ordnungszahlen 21 bis 30, 39 bis 48, 57 bis 80 und 89 bis 112) werden wegen ihrer Fähigkeit benötigt, im Stoffwechsel Metallkomplexe, häufig Chelatkomplexe, zu bilden. Jedes Metallion hat eigene (passende) Chelatoren, die einen Hohlraum geeigneter Größe aufweisen. Besonders Proteine mit ihren funktionellen Gruppen können als Liganden auftreten. Folglich einige Wertigkeitsstufen und Koordinationszahlen wichtiger Ionen:
| Mn2+/Mn3+/Mn4+ (4-6) | Fe2+/Fe3+ (6) | Co2+/Co3+ (6) | Cu2+ (4) | Zn2+ (4) |
Metalloenzyme
Fast ein Drittel der Enzyme im menschlichen Körper erfordern die Anwesenheit von Metallionen, um katalytische Aktivität zu entfalten. Diese Enzyme werden als Metalloenzyme bezeichnet, zu denen zum Beispiel die Peptidasen gehören. Diese benötigen Zn2+, um eine reaktionsfähige Konformation zu erlangen und zugleich eine hydrolysierende Peptidgruppe für den Angriff des Wassers zu aktivieren.
Zinkfinger-Proteine binden ebenfalls Zn2+. Dadurch bildet sich eine Schleife, über die das Protein mit Abschnitten der DNA interagiert. Zinkfingerdomänen sind Bestandteile vieler Transkriptionsfaktoren.
Hämoglobin
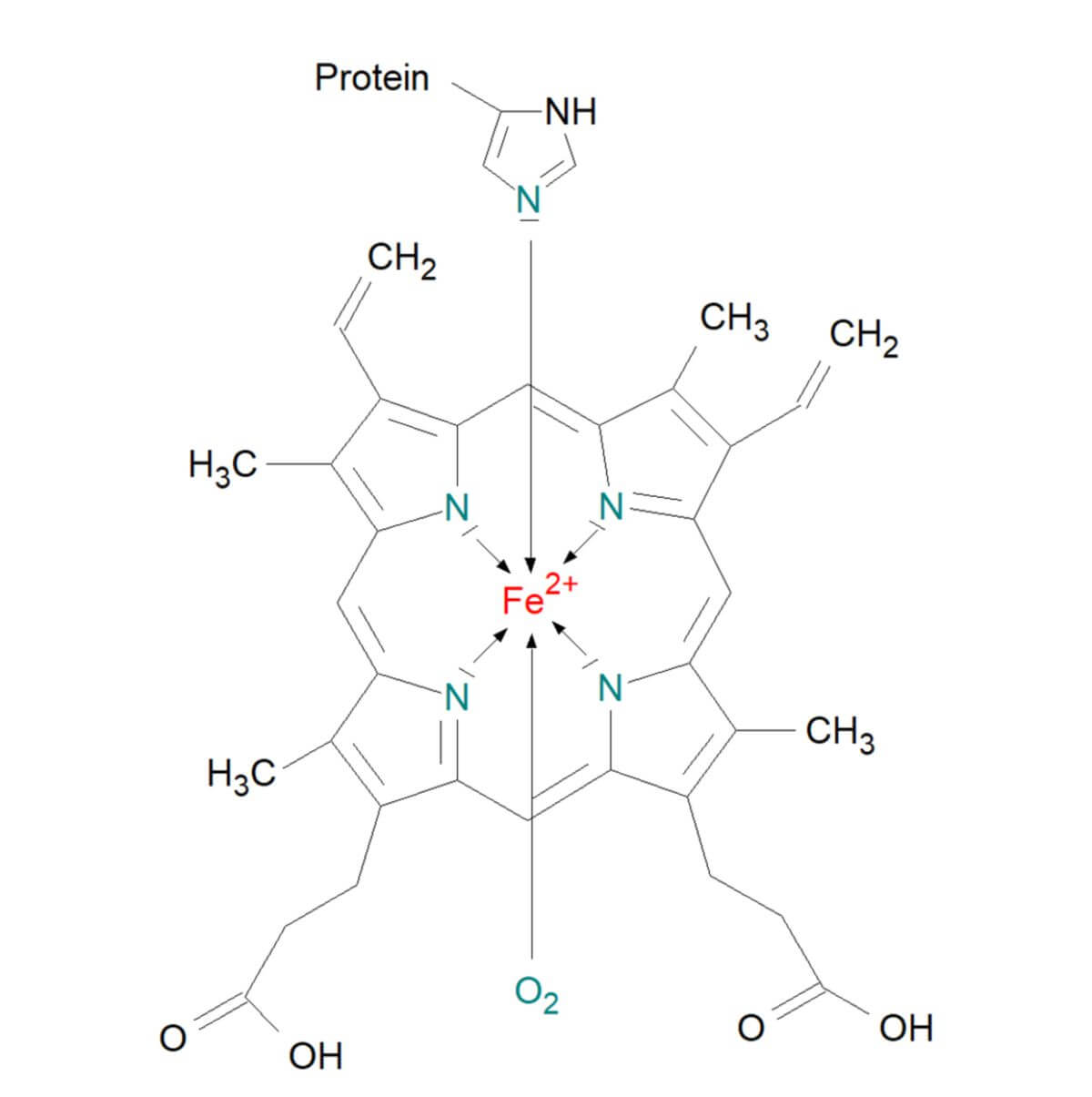
Hämoglobin ist von großer Bedeutung für den Sauerstofftransport im Blut. Es ist ein Metalloprotein, das den roten Blutzellen (Erythrozyten) ihre Farbe verleiht. Hämoglobin weist eine Molmasse von 64.500 Da auf und besteht aus vier Proteinketten mit je einer Häm-Gruppe. Häm ist ein Chelatkomplex, bestehend aus von einem vierzähnigen Tetrapyrrol-Ringsystem (Porphyrin) mit einem Fe2+-Ion im Zentrum. Die vier Koordinationsstellen des Zentralions werden von den vier N-Atomen (Stickstoffatome) der Pyrrolringe besetzt. Die Gesamtladung des Häms ist deshalb null, da zwei Pyrrolringe jeweils ein Proton abgegeben haben und somit als Anion vorliegen. Da das Ringsystem über die Doppelbindung konjugiert ist, sind die vier koordinativen Bindungen zum Zentralion des Häms gleichwertig.
Am Fe2+ befindet sich auch noch eine fünfte Koordinationsstelle. Diese nimmt das freie Elektronenpaar des N-Atoms des sog. proximalen Histidin-Rests ein (eine Seitenkette der Helix F) und bindet damit die Häm-Gruppe kovalent an das Proteinmolekül. An die sechste Koordinationsstelle lagert sich reversibel Sauerstoff an. Da Hämoglobin in jeder der vier Proteinketten eine Häm-Gruppe trägt, kann es folglich auch vier Moleküle Sauerstoff (O2) in den Alveolen der Lunge aufnehmen und im Gewebe wieder abgeben.
Die Beladung mit dem Sauerstoff hat zur Folge, dass das Hämoglobin seine Farbe verändert. Das venöse Blut ist purpurrot, das arterielle (mit Sauerstoff beladen) Blut dagegen scharlachrot. Zudem ändert das Hämoglobin seine Raumstruktur und es gibt kooperative Effekte hinsichtlich der Sauerstoffbeladung. Die Tendenz der Aufnahme des vierten O2-Moleküls ist somit stärker als die für das erste. Obwohl eine direkte Berührung von Fe2+ und Sauerstoff stattfindet, tritt kein Wechsel der Wertigkeit des Eisens ein. Das Eisen bleibt zweiwertig, das heißt, während des Sauerstofftransportes findet keine Redoxreaktion statt. Geschieht aufgrund anderer Bedingungen eine Oxidation des Zentralions zu Fe3+, so entsteht Methämoglobin. Dieses kann keinen Sauerstoff mehr transportieren.
Kohlenmonoxid (CO) stellt ein starkes Atemgift dar, da es mit einer etwa 200-fach höheren Affinität als Sauerstoff an das Fe2+-Ion des Häms bindet und damit den Sauerstofftransport erheblich stört. Die Bindung von CO an das Zentralion ist deshalb bevorzugt, da Elektronen des Zentralions über diesen Liganden delokalisiert werden. Neben der üblichen σ-Bindung entsteht zusätzlich eine partielle (teilweise) π-Bindung zwischen Zentralion und dem Liganden.
Entgiftung
Chelatoren findet man in folgenden Anwendungen:
- Werden lebende Organismen mit geeigneten Chelatoren behandelt, so binden diese Verbindungen mehr oder weniger stark die in der Umgebung vorhandenen Metallionen. Die Folge kann sein, dass ein Mangel an diesen Metallionen eintritt und wichtige Spurenelemente nicht mehr verfügbar sind.
- Liegt eine Schwermetallvergiftung vor, können giftige Schwermetallionen (z.B. Pb2+, Hg2+, Cd2+) durch geeignete Chelatoren, z.B. EDTA, zur Ausscheidung gebracht werden (Entgiftung).
- Will man die Blutgerinnung (die nur in der Gegenwart von freien Ca2+-Ionen abläuft) außerhalb des Körpers unterbinden, so kann man dies durch die Zugabe von EDTA oder Citrat erreichen. Je nach Untersuchungsziel verwendet man deshalb bei der Blutabnahme spezielle Röhrchen, z.B. eine EDTA-Monovette (rot) oder eine Citrat-Monovette (grün), die den jeweiligen Chelator bereits enthalten.
- Soll der Gehalt von Metallionen in einer Lösung definiert werden, kann dies durch Titration erfolgen. Dies geschieht beispielsweise mit einer 0,1 M EDTA-Lösung. Mit Hilfe eines Komplex-Indikators wird der Äquivalenzpunkt angezeigt. Dieser Punkt weist mit Metallionen eine andere Farbe auf als ohne. Jedoch muss beachtet werden, dass der Kf-Wert des Indikators für ein bestimmtes Metallion größer ist als der von EDTA, damit es zum Farbumschlag kommen kann. Man kann z.B. die Härte des Wassers, die vom Gehalt an Ca2+-Ionen abhängt, durch Titration (Komplexometrie) bestimmen.
Quellen
- Zeeck, Chemie für Mediziner, 8. Auflage, Urban & Fischer Verlag/Elsevier GmbH, 2014