Löslichkeitsprodukt
Synonym: Löslichkeitskonstante
Englisch: solubility product
Definition
Das Löslichkeitsprodukt ist ein fester Wert, der der Bestimmung der maximalen Löslichkeit eines Salzes in einem Lösungsmittel dient. Er lässt sich durch die Multiplikation der beiden Konzentrationen in Lösung mit Hilfe von Wertetabellen berechnen.
Für ein Molekül AnBm gilt also:
- L = [A]n x [B]m
Beim Überschreiten des Löslichkeitsproduktes kommt es damit zum Ausfallen der Ionen dieses Salzes in der Lösung (Fällungsreaktion).
Hintergrund
Man unterscheidet leicht lösliche (z.B. Alkali- und Erdalkalihalogenide) und schwer lösliche Salze (z.B. Silberhalogenide, Schwermetallsulfate und -sulfide). Deren Löslichkeit wird über das Löslichkeitsprodukt L definiert. Es lässt sich aus dem Massenwirkungsgesetz (MWG) ableiten. Je kleiner das Löslichkeitsprodukt L ist, desto geringer ist die Löslichkeit des Salzes.
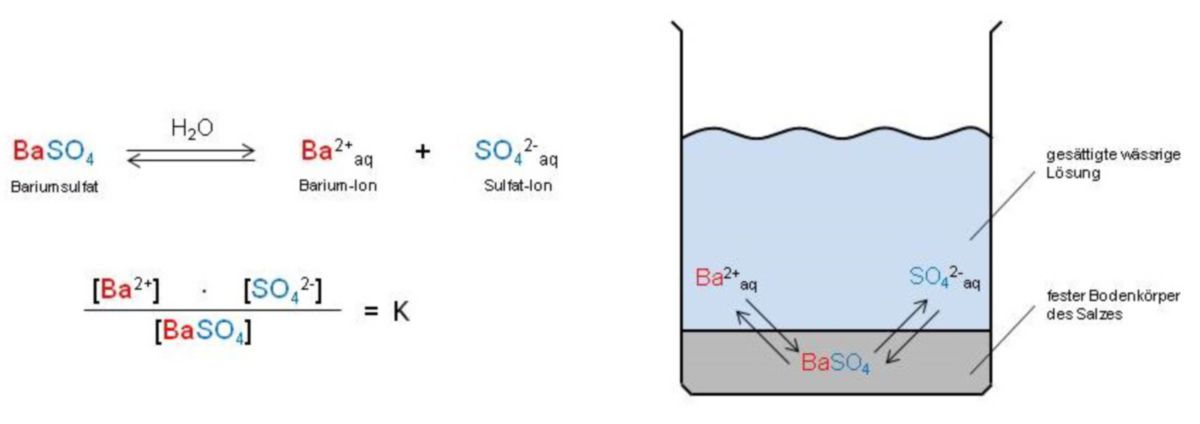
Nimmt man eine gesättigte Salzlösung, die mit dem festen Bodenkörper des Salzes in Kontakt steht, ist diese ein typisches Beispiel für ein dynamisches, heterogenes Gleichgewicht. Es gehen somit ständig Ionen vom Bodenkörper in die Lösung, wobei sich gleichzeitig wieder Ionen aus der Lösung am Festkörper abscheiden.
Abbildung: Es ist ersichtlich, dass festes Salz (hier BaSO4) als Bodenkörper vorhanden ist. Somit bleibt seine Konzentration konstant und wird gleich 1 gesetzt. Es bleibt dann das Produkt der Konzentration der gelösten Ionen übrig. Dieses Produkt ist für ein bestimmtes Salz bei gegebener Temperatur eine Konstante und wird als Löslichkeitsprodukt bezeichnet. Die in der Grafik angeführten eckigen Klammern stehen für die Konzentration der Ionen in mol/L: Das Löslichkeitsprodukt für BaSO4 beträgt 10-10 mol2/L2.
Medizinischer Bezug
Medizinische Relevanz hat das Löslichkeitsprodukt als Erklärungsmodell für die Entstehung von Konkrementen, beispielsweise im Rahmen von Nierensteinen. Überschüssige Ionen werden über die Niere im Harn ausgeschieden. Daher ist es möglich, dass in der Niere vorübergehend höher konzentrierte Salzlösungen oder gar übersättigte Lösungen von Salzen entstehen. Jedoch verhindern Schutzstoffe im Harn, dass Salze ausfallen oder auskristallisieren. Es ist aber möglich, dass diese Schutzstoffe fehlen und somit eine Nieresteinbildung eintritt. Diese Steine können z.B. aus Calciumoxalat (Ca2+, -OOC—COO-), Calciumphosphat [Ca3(PO4)2] oder Magnesiumammoniumphosphat (MgNH4PO4) bestehen.
Eingang in die Medizin findet das Löslichkeitsprodukt auch in der Knochen- und Zahnbildung. Als Mineralisierung bezeichnet man nämlich den Einbau von schwer löslichen Salzen in bestimmte Körpergewebe. Das komplexe Salz Hydroxylapatit [Ca5(PO4)3OH], das aus Calciumphosphat und Calciumhydroxid besteht, ist mit einem Anteil von über 50% am Aufbau des menschlichen Skeletts und der Zähne beteiligt und macht etwa 90% der Mineralsubstanz des Körpers aus.
Beispiele
- Es soll herausgefunden werden, wie groß die Konzentration an gelösten Ba2+aq in einer gesättigten Lösung von Bariumsulfat ist.
| Reaktionsgleichung: | BaSO4 +H2O⇌ Ba2+aq + SO2-aq |
| L = [Ba2+] · [SO42-] = 10-10 mol2/L2 | |
| Da [Ba2+] = [SO42-] gilt: |
[Ba2+]2 = 10-10 mol2/L2 |
| Daraus ergibt sich: | [Ba2+] = 10-5 mol/L |
| Antwort: | Es sind 10-5 mol/L Bariumsulfat in einer gesättigten Bariumsulfatlösung gelöst. |
In der Medizin wird das Bariumsulfat als Röntgenkontrastmittel für Untersuchungen des gesamten Verdauungstraktes genutzt (Bariumbrei). Ba2+-Ionen sind zwar giftig, aber wegen der geringen Löslichkeit des Salzes stellen sie jedoch keine Gefahr für den Menschen dar.
- Wie viel mg BaSO4 sind in 1 Liter Wasser löslich?
Aufgrund der Molmasse von BaSO4 (233 g/mol) ergibt sich, dass in einem Liter 233 g/mol · 10-5 mol/L = 0,00233 g/L BaSO4 gelöst sind. Das entspricht 2,33 mg/L. Da hier eine gesättigte Lösung vorliegt, gibt dieser Wert zugleich die Löslichkeit von BaSO4 an. Liegen darüber hinausgehende Salzmengen vor, so sind sie als Bodensatz vorzufinden.
Einheiten für Löslichkeitsprodukte
Es ergeben sich für Salze verschiedener Zusammensetzung verschiedene Einheiten für das Löslichkeitsprodukt. Grund dafür ist, dass sich die Zahl der Ionen in der Salzformel als Hochzahl im Löslichkeitsprodukt (L) wiederfindet.
Beispiele
| Salz 1: | AB (z.B. AgCl, Silber(I)-chlorid) |
L = [A+] · [B-] mol2/L2 L (AgCl) = 2 · 10-10 mol2/L2 |
| Salz 2: | A2B (z.B. Ag2S, Silber(I)-sulfid) |
L = [A+]2 · [B2-] mol3/L3 L (Ag2S) = 6 · 10-51 mol3/L3 |
| Salz 3: | AB2 (z.B. CaF2, Calciumfluorid) |
L = [A2+] · [B-]2 mol3/L3 L (CaF2) = 4 · 10-11 mol3/L3 |