Amyloid
von altgriechisch: αμυλοειδούς - "stärkeähnlich"
Englisch: amyloid
Definition
Amyloide sind große Proteinaggregate, die aus β-Faltblättern aufgebaut sind. Sie treten pathologisch im Rahmen einer Amyloidose auf, können aber auch funktionelle Bedeutung haben.
Nomenklatur
Der Begriff Amyloid wurde im 19. Jahrhundert durch den Pathologen Rudolf Virchow geprägt. Er ging davon aus, dass die Ablagerungen stärkeartig seien, da sie sich mit Jod-Schwefelsäure blau-violett färbten. Diese Vermutung erwies sich später als falsch, der Name wurde jedoch beibehalten.
Struktur
Amyloide bestehen aus langen, unverzweigten Fasern, deren charakteristische Sekundärstruktur β-Faltblätter sind. Jeweils zwei miteinander verbundene, parallel zur Faserachse ausgerichtete β-Faltblätter bilden den molekularen Grundbaustein der Amyloide. Diese Faltblätter sind aus β-Strängen aufgebaut, die einen Abstand von jeweils 4,7 Å aufweisen und senkrecht zur Längsachse der Faser laufen. Eine solche Anordnung wird aufgrund ihrer charakteristischen Röntgenbeugungssignatur als Cross-β-Struktur bezeichnet.
Tausende repetitiv aneinandergereihter β-Faltblätter bilden die sogenannten "Protofilamente". Sie sind 7 bis 13 Nanometer breit und können einige Mikrometer lang sein.[1] Mehrere Protofilamente lagern sich sich schließlich zu einer Amyloidfibrille zusammen.[2]
Die wichtigsten Erkennungsmerkmale, anhand derer man Proteinaggregate als Amyloid klassifiziert, sind:
- eine fibrilläre Morphologie mit dem typischen Durchmesser, sichtbar durch Transmissionselektronenmikroskopie (TEM) oder Rasterkraftmikroskopie (AFM)
- das Vorhandensein einer Cross-β-Sekundärstruktur, nachgewiesen durch zirkuläre CD-Spektroskopie, Fourier-Transform-Infrarot-Spektroskopie (FTIR), Festkörper-Kernspinresonanz (ssNMR), Röntgenkristallographie oder Röntgenfaserbeugung
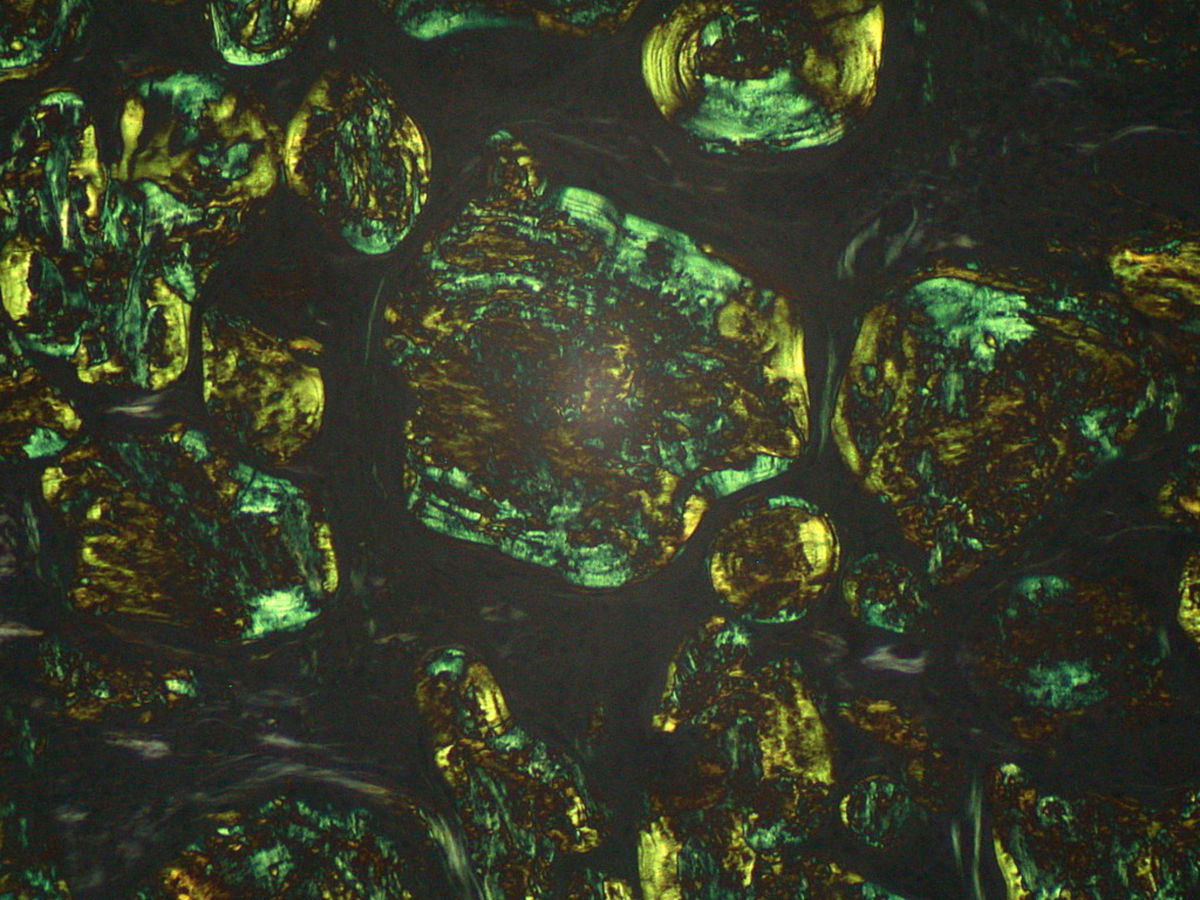
- die Fähigkeit, sich mit spezifischen Farbstoffen anfärben zu lassen, z.B. Kongorot , Thioflavin T oder Thioflavin S
- grün-gelbliche Doppelbrechung im polarisierten Licht
Klassifizierung
Derzeit (2025) unterscheidet die Nomenklatur der International Society of Amyloidosis (ISA) mehr als 40 verschiedene Typen von Amyloidfibrillen.[2]
| Fibrillenprotein | Vorläuferprotein | Fokus | Status | Zielorgane/Erkrankung |
|---|---|---|---|---|
| AL | Immunglobulin-Leichtkette | S, L | E, H | All Organe außer ZNS |
| AH | Immunglobulin-Schwerkette | S, L | E | All Organe außer ZNS |
| AA | Serumamyloid A | S | E, H | All Organe außer ZNS |
| ATTR | Transthyretin, Wildtyp | S | E | Herz, Lunge, Bänder, Sehnen |
| Transthyretin, Varianten | S | H | PNS, ANS, Herz, Auge, Nieren, Pia mater | |
| Aβ2M | β2-Mikroglobulin, Wildtyp | S | E | Muskuloskelettales System |
| β2-Mikroglobulin, Varianten | S | H | ANS, Zunge, Herz | |
| AApoAI | Apolipoprotein A1, Varianten | S | H | Herz, Leber, Nieren, PNS, Hoden, Larynx, Haut |
| AApoAII | Apolipoprotein A2, Varianten | S | H | Nieren |
| AApoAIV | Apolipoprotein A4, Wildtyp | S | E | Nierenmark, Herz, Gastrointestinaltrakt |
| AApoAIV | Apolipoprotein A5, Varianten | S | H | Herz, Nieren |
| AApoCII | Apolipoprotein C2, Varianten | S | H | Nieren |
| AApoCIII | Apolipoprotein C3, Varianten | S | H | Nieren |
| AGel | Gelsolin, Varianten | S | H | Nieren, PNS, Kornea |
| ALys | Lysozym, Varianten | S | H | Nieren |
| ALECT2 | Leukozyten-chemotaktischer Faktor 2 | S | E | Nieren, primär |
| AFib | Fibrinogen α, Varianten | S | H | Nieren, primär |
| ACys | Cystatin C, Varianten | S | H | PNS, Haut |
| ABri | ABriPP, Varianten | S | H | ZNS |
| ADan | ADanPP, Varianten | L | H | ZNS |
| Aβ | Amyloid-Precursor-Protein, Wildtyp/Varianten | L | E, H | ZNS |
| AαSyn | α-Synuclein/Variante | L | E, H | ZNS |
| ATau | Tau/Variante | L | E, H | ZNS |
| APrP | Prionprotein, Wildtyp/Varianten | L | E, H | CJD, Letale familiäre Insomnie, GSS-Syndrom |
| Prionprotein Variante | S | H | PNS | |
| ATMEM106B | Transmembranprotein 106B (TMEM106B) | L | E | Frontotemporale Demenz |
| ACal | (Pro)calcitonin | L, S | E | Medulläres Schilddrüsenkarzinom, Nieren |
| AIAPP | Amylin | L | E | Langerhans-Inseln, Insulinom |
| AANP | Atriales natriuretisches Peptid | L | E | Herzvorhöfe |
| APro | Prolaktin | L | E | Prolaktinome, alternde Hypophyse |
| ASom | (Pro)somatostatin | L | E | Somatostatinome |
| AGluc | Glucagon | L | E | Glucagonome |
| APTH | Nebenschilddrüsenhormon | L | E | Nebenschilddrüsentumoren, alternde Nebenschilddrüse |
| AIns | Insulin | L | E | Iatrogen, Lokalinjektion |
| AEnf | Enfuvirtid | L | E | Iatrogen, Lokalinjektion |
| AGLP1 | Glucagon-like Peptide-1-Analog | L | E | Iatrogen, Lokalinjektion |
| AIL1RAP | Interleukin-1-Rezeptorantagonist (IL-1RA | S, L | E | Iatrogen, Lokalinjektion |
| ASPC | Surfactant-Protein A | L | E | Lunge |
| ACor | Corneodesmosin | L | E | Verhorntes Epithel, Haarfollikel |
| AMed | Lactadherin (MFG-E8) | L | E | Alternde Aorta, Media, elastische Arterien |
| AKer | Keratoepithelin | L | E | Kornea |
| ALac | Lactoferrin | L | E | Kornea |
| AOAAP | Odontogenes Ameloblasten-assoziiertes Protein (ODAM) | L | E | Odontogene Tumore |
| ASem1 | Semenogelin 1 | L | E | Vesicula seminalis |
| ACatK | Cathepsin K | L | E | Tumor-assoziiert |
| AEFEMP1 | EFEMP1 | L | E | Venen, altersassoziiert |
S = systemisch, L = lokal, E = erworben, H = hereditär
Funktionelle Amyloide
Neben pathogenen Amyloiden gibt es beim Menschen auch physiologische bzw. funktionelle Amyloide. Beispielsweise werden bestimmte Peptidhormone in sekretorischen Granula der Hypophyse in Form von Amyloiden gespeichert.[3] Im Rahmen der Apoptose bilden die Serin/Threonin-Kinasen RIP1 und RIP3 ein heterodimeres Amyloid, das als Signalkomplex für den programmierten Zelltod dient.[4]
Quellen
- ↑ Riek R. The Three-Dimensional Structures of Amyloids. Cold Spring Harb Perspect Biol. 2017 Feb 1;9(2):a023572. doi: 10.1101/cshperspect.a023572. PMID: 27793967; PMCID: PMC5287077.
- ↑ 2,0 2,1 Buxbaum JN, Eisenberg DS, Fändrich M, McPhail ED, Merlini G, Saraiva MJM, Sekijima Y, Westermark P. Amyloid nomenclature 2024: update, novel proteins, and recommendations by the International Society of Amyloidosis (ISA) Nomenclature Committee. Amyloid. 2024 Dec;31(4):249-256. doi: 10.1080/13506129.2024.2405948. Epub 2024 Sep 30. PMID: 39350582.
- ↑ Maji SK, Perrin MH, Sawaya MR, Jessberger S, Vadodaria K, Rissman RA, Singru PS, Nilsson KP, Simon R, Schubert D, Eisenberg D, Rivier J, Sawchenko P, Vale W, Riek R. Functional amyloids as natural storage of peptide hormones in pituitary secretory granules. Science. 2009 Jul 17;325(5938):328-32. doi: 10.1126/science.1173155. Epub 2009 Jun 18. PMID: 19541956; PMCID: PMC2865899.
- ↑ Li J, McQuade T, Siemer AB, Napetschnig J, Moriwaki K, Hsiao YS, Damko E, Moquin D, Walz T, McDermott A, Chan FK, Wu H. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 2012 Jul 20;150(2):339-50. doi: 10.1016/j.cell.2012.06.019. PMID: 22817896; PMCID: PMC3664196.