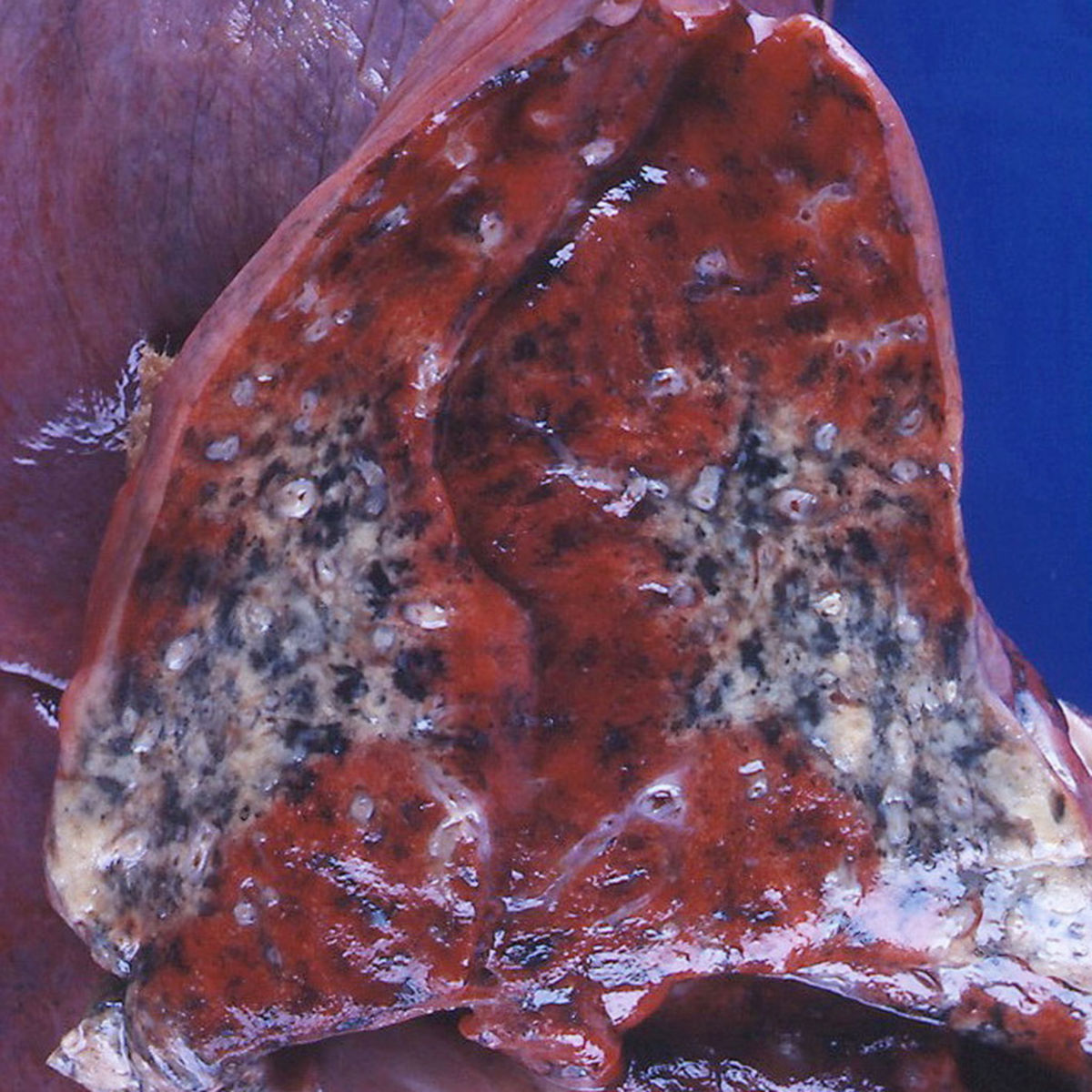
Granulomatose mit Polyangiitis
Synonyme: Morbus Wegener, Allergische Angiitis und Granulomatose, Klinger-Wegener-Churg-Syndrom (bzw. Wegener-Klinger-Churg-Syndrom), rhinogene Granulomatose, Riesenzellgranuloarteriitis Wegener-Klinger-Churg, Granulomatosis Wegener, Wegenersche Granulomatose
Englisch: granulomatosis with polyangiitis, Wegener's granulomatosis
Definition
Die Granulomatose mit Polyangiitis, kurz GPA, ist eine rheumatische Erkrankung, die mit granulomatösen Veränderungen der Atemwege und einer Entzündung der mittleren und kleinen Blutgefäße einhergeht. Sie gehört zur Gruppe der ANCA-assoziierten Vaskulitiden.
- ICD10-Code: M31.3
Nomenklatur
Seit 2011 empfehlen internationale rheumatologische Fachgesellschaften die Bezeichnung "Morbus Wegener" durch Granulomatose mit Polyangiitis zu ersetzen. Grund hierfür ist die Vergangenheit des deutschen Pathologen Friedrich Wegener (1907–1990) während der Zeit des Nationalsozialismus. Wegener war Mitglied der NSDAP, SA und des Nationalsozialistischen deutschen Ärztebundes (NSDÄB).
Epidemiologie
Die Inzidenz der GPA beträgt etwa 0,9/100.000 pro Jahr. Dabei sind Männer und Frauen gleich häufig betroffen. Der Häufigkeitsgipfel liegt im vierten Lebensjahrzehnt.
Ätiologie
Die Ursache der GPA ist derzeit (2020) unklar. Ein Zusammenhang mit einer chronischen Besiedlung mit Staphylococcus aureus wird diskutiert.
Einteilung
...nach EUVAS
Die GPA kann nach EUVAS (European Vasculitis Study Group) in fünf klinische Subgruppen eingeteilt werden:
| Subgruppe | Beschreibung |
|---|---|
| Lokalisierte GPA |
|
| Frühe systemische GPA |
|
| Generalisierte GPA |
|
| Schwere GPA |
|
| Refraktäre GPA |
|
...nach VCRC
Das VCRC (Vasculitis Clinical Research Consortium) unterscheidet bei der GPA zwei Verläufe (unabhängig vom Serumkreatinin):
| Verlauf | Beschreibung |
|---|---|
| Limitierter Verlauf |
Lokalisiertes oder frühes systemisches Stadium nach EUVAS |
| Schwerer Verlauf |
Zusätzlich lebensbedrohliche Organdysfunktion |
Symptomatik
Lokalisiertes Stadium
Die Granulomatose mit Polyangiitis beginnt in 90 % d.F. als lokal begrenzte Erkrankung in den Atemwegen.[1] Es kommt initial also nicht zu einer Glomerulonephritis oder anderen systemischen Krankheitsmanifestationen. Typische Manifestationen der lokal begrenzten Granulomatose mit Polyangiitis sind:
- Rhinitis: häufig chronische, ulzerierende Verläufe über lange Zeit mit blutigem Schnupfen
- Übergreifen der Entzündung auf die Nasennebenhöhlen (Sinusitis) und das Mittelohr (Otitis), borkige Krustenbildung in der Nasenhöhle.
- Lungenrundherde, häufig als Zufallsbefund, entsprechen in der Bildgebung so genannten Pseudokavernen, eventuell Bronchialstenosen bzw. subglottische Trachealstenosen
- Ulzerationen der Schleimhaut an Mund und Rachen
Die Ulzerationen im Nasenrachenbereich können zur Nasendeformation (Septumdeviation Nasenseptumperforation, Sattelnase) führen.
Generalisiertes Stadium
Im weiteren Verlauf kommt es zu generalisierten Symptomen. Gefürchtet ist die Pauci-Immun-Glomerulonephritis (50 % d.F.), die weder Ablagerungen von Antikörpern oder Immunkomplexen aufweist. Sie verläuft häufig unter dem pathologischen Muster einer RPGN. Weiterhin kann es durch ausgedehnten Befall der Lungen (60 %) im Sinne einer Pneumonie zu Husten, Dyspnoe und Einblutungen mit Hämoptysen kommen. Das kombinierte Auftreten wird als pulmorenales Syndrom bezeichnet.
Weitere mögliche Manifestationen sind:
- Gelenke und Muskulatur: Arthralgien und Myalgien
- Augen (50 %): Konjunktivitis, Episkleritis, retinale Vaskulitis, Zentralarterienverschluss
- Haut (20 %): Purpura, Papeln, Bläschen, Ulzera (z.B. an Fingerkuppen)
- Nervensystem (10 %): zerebrale Vaskulitis, Neuritis nervi optici, Meningitis, periphere Neuropathie
- Herz (10 %): Perikarditis, Vaskulitis der Koronararterien, Kardiomyopathie
Häufig kommt es im systemischen Krankheitsstadium zur Entwicklung einer B-Symptomatik (Fieber, Nachtschweiß, Gewichtsverlust)
Häufigkeit der Symptome
| Organ | Manifestation | zu Beginn (in %) | im Verlauf (in %) |
|---|---|---|---|
| Niere | Glomerulonephritis | 18 | 77 |
| Hals, Nase, Ohren | Gesamt: | 73 | 92 |
| Sinusitis | 51 | 85 | |
| Nasale Erkrankungen | 36 | 68 | |
| Otitis media | 25 | 44 | |
| Hörverlust | 14 | 42 | |
| Subglottische Stenose | 1 | 16 | |
| Ohrenschmerzen | 9 | 14 | |
| Orale Läsionen | 3 | 10 | |
| Lunge | Gesamt: | 45 | 85 |
| Pulmonale Infiltrate | 25 | 66 | |
| Pulmonale Rundherde | 24 | 58 | |
| Hämoptysen | 12 | 30 | |
| Pleuritis | 10 | 28 | |
| Augen | Konjunktivitis | 5 | 18 |
| Dakrozystitis | 1 | 18 | |
| Skleritis | 6 | 16 | |
| Exophthalmus | 2 | 15 | |
| Augenschmerzen | 3 | 11 | |
| Visusverlust | 0 | 8 | |
| Netzhautläsionen | 0 | 4 | |
| Hornhautläsionen | 0 | 1 | |
| Iritis | 0 | 2 | |
| Andere | Arthralgien/Arthritis | 32 | 67 |
| Fieber | 23 | 50 | |
| Husten | 19 | 46 | |
| Hautläsionen | 13 | 46 | |
| Gewichtsverlust > 10 % | 15 | 35 | |
| Periphere Neuropathie | 1 | 15 | |
| ZNS-Beteiligung | 1 | 8 | |
| Perikarditis | 2 | 6 | |
| Hyperthyreose | 1 | 3 | |
| Quelle: "Wegener's granulomatosis: An analysis of 158 patients" (Ann Intern Med 116:488, 1992, zitiert nach: Harrisons Innere Medizin, dt. Ausgabe der 15. Auflage – Berlin 2003, ISBN 3-936072-10-8, S. 2146-2149) | |||
Diagnostik
Der Verdacht einer Granulomatose mit Polyangiitis ergibt sich durch klinische und labormedizinische Zeichen sowie mit Hilfe bildgebender Verfahren. Die Sicherung der Diagnose erfolgt mittels Biopsie und histologischer Untersuchung.
Labordiagnostik
Als Test auf eine GPA hat sich in der Labormedizin die Bestimmung von c-ANCA durchgesetzt. Die Antikörper richten sich gegen PR3, eine Proteinase der neutrophilen Granulozyten. C-ANCA sind bei der GPA im generalisierten Stadium in 80-90 % d.F. nachweisbar, jedoch korreliert ihr Titer nicht zuverlässig mit der Krankheitsaktivität. Beispielsweise sind Anstiege der c-ANCA-Werte im Blut häufig schon deutlich vor dem Auftreten eines Rezidivs nachweisbar. Weitere serologische Befunde sind:
- ANA positiv bei 10-20 % der Patienten
- Rheumafaktor positiv bei 60-70 % der Patienten
Weitere unspezifische Laborbefunde in Zusammenhang mit einer GPA sind:
- Erhöhung von ESR und CRP
- erhöhtes Serumkreatinin (bei Nierenbeteiligung)
- normochrome normozytäre Anämie (50 %)
- Leukozytose, Thrombozytose
- Hämaturie, Proteinurie, dysmorphe Erythrozyten und Erythrozytenzylinder im Urinsediment (bei Glomerulonephritis)
Bildgebung
Röntgen-Thorax
Im Röntgen-Thorax können bei 40 bis 70 % der Patienten eventuell Lungenrundherde bzw. Raumforderungen auffallen. Dabei zeigt sich in bis zu 50 % der Fälle eine Kavität. Die Wand kann dünn, dick oder nodulär sein. Intrakavitäre Luft-Flüssigkeits-Spiegel sind hinweisend auf eine Sekundärinfektion.
Weiterhin können flächige Verschattungen auffallen, die einer pulmonalen Hämorrhagie, einem Lungeninfarkt oder einer organisierenden Pneumonie entsprechen. Typisch sind subpleurale, keilförmige Konsolidierungen mit zentraler Nekrose oder Kavität. Seltener finden sich retikuläre Verschattungen oder Atelektasen. Auch eine subglottische Stenose kann vorkommen.
Das Röntgen-Thorax wird insbesondere zum Therapiemonitoring verwendet: Hinweisend auf ein Therapieansprechen sind eine abnehmende Rundherdgröße, eine abnehmende Wanddicke von Kavitäten und eine Zunahme der Randirregularität von Läsionen.
CT
In der CT-Thorax finden sich bei 90 % der Patienten Lungenrundherde (< 3 cm) bzw. Raumforderungen (> 3 cm). Sie sind meist 2 bis 4 cm groß, gut umschrieben und kommen oft multipel und bilateral in zufälliger Verteilung vor. 50 % der Rundherde weisen eine Kavität auf, insbesondere die größeren Läsionen. Die Wand der Kavität ist häufig dick und irregulär. Durch die Therapie können die Kavitäten verschwinden und die Wand dünner werden.
Weitere thorakale Befunde sind:
- Milchglastrübungen:
- diffuse alveoläre Hämorrhagie: ggf. mit subpleuraler Aussparung und verdickten Interlobulärsepten durch lymphatische Kongestion oder Akkumulation von Hämosiderin-beladenen Makrophagen
- Mosaikperfusion: durch Beteiligung von Arteriolen
- Halo-Zeichen: Milchglastrübungen um Noduli, Raumforderungen oder Konsolidierungen. Ausdruck der pulmonalen Hämorrhagie um die Läsion.
- Atoll-Zeichen: Konsolidierung um zentrale Milchglastrübung. Ausdruck der organisierenden Pneumonie in der Peripherie einer pulmonalen Hämorrhagie
- Feeding Vessel Sign: Lungengefäße verlaufen zu den Noduli hin.
- Zentrilobuläre Mikronoduli: Hämosiderose als Komplikation rezidivierender alveolärer Hämorrhagien
- Lungenfibrose: subpleurale Retikulationen, Honeycombing, betont in peripheren und kaudalen Lungenarealen
- Konsolidierungen
- Parenchymbänder
- Bronchialwandverdickungen
- verdickte Interlobulärsepten
- Verdickung der Atemwege: Trachea bis subsegmentale Atemwege können betroffen sein. Fokal oder langstreckig. Meist milde Ausprägung, aber eine Obliteration kann vorkommen.
- Pleurabeteiligung: Pleuraergüsse sind häufig. Pleuraverdickung, Empyem und Pneumothorax kommen nur selten vor.
- mediastinale Lymphadenopathie: kommt bei 15 % der Patienten mit Lungenveränderungen vor.
Im Nasennebenhöhlen-CT können granulomatöse Veränderungen vorkommen.
MRT
Bei Verdacht auf zerebralen Befall wird in der Regel eine Magnetresonanztomographie (MRT) durchgeführt.
Nuklearmedizin
In der Gallium-67-Szintigraphie zeigen die GPA-Läsionen in der Regel einen vermehrten Uptake. Die Untersuchung wird insbesondere zum Therapiemonitoring eingesetzt. Des Weiteren zeigen die Läsionen einen vermehrten FDG-Uptake in der PET-CT.
Histopathologie
Als diagnostischer Goldstandard dient die histopathologische Untersuchung einer Biopsie, die man aus der Nase oder anderen befallenen Organen (Lunge, Niere) entnimmt. Die Granulomatose mit Polyangiitis ist charakterisiert durch:
- nekrotisierende, z.T. granulomatöse Vaskulitis der kleinen Arterien und Venen
- Glomerulonephritis
- Granulome (intra- und extravaskulär)
In Nierenbiopsien sind häufig Mikroaneurysmata als Ausdruck abgelaufener vaskulitischer Episoden festzustellen.
Differenzialdiagnosen
Radiologisch kommen verschiedene Differenzialdiagnosen in Frage, beispielsweise:
- Lungenmetastasen: meist gut umschriebene Noduli bzw. Raumforderungen. Hämorrhagische Metastasen (z.B. Nierenzellkarzinom, malignes Melanom, Chorionkarzinom) können ebenfalls irreguläre Ränder und eine umgebende Milchglastrübung aufweisen. Kavitäten kommen z.B. beim Plattenepithelkarzinom und Sarkomen vor.
- Septische Embolien: unscharf begrenzte Noduli oder Raumforderungen mit variablem Ausmaß einer Kavität.
- Lungenabszesse: Raumforderung mit Kavität, ggf. mit Luft-Flüssigkeits-Spiegel und mit perifokalen Konsolidierungen oder Milchglastrübungen.
- Tuberkulose: Die Differenzierung gelingt insbesondere über die Anamnese und mikrobiologische Diagnostik.
- Tracheobronchiale Amyloidose: meist diffuse Atemwegsbeteiligung, ggf. mit getüpfelten Verkalkungen.
Therapie
Bei gesicherter Diagnose sollte umgehend eine Remissionsinduktion eingeleitet werden. Anschließend wird eine Remissionserhaltung durchgeführt. Wichtig ist es, die Nierenschädigung als die Lebenserwartung begrenzenden Faktor möglichst minimal zu halten. Engmaschige Kontrollen und eine konsequente medikamentöse Therapie sind hierfür notwendig.
Remissionsinduktion
Die Wahl der Remissionsinduktion wird individuell in Abhängigkeit vom Ausmaß der Erkrankung gewählt. Besteht keine akute Lebensgefahr oder Beteiligung lebenswichtiger Organe (z.B. Hautbefall ohne Ulzerationen, Myositis, nasale Erkrankung ohne Involvierung des Knochens) wird eine immunsuppressive Kombinationstherapie empfohlen:
- Prednisolon 1 mg/kgKG p.o. (maximal 80 mg/d), innerhalb 12 Wochen auf 15 mg/d reduzieren, dann ausschleichen
- und Methotrexat 0,3 mg/kgKG p.o., s.c. oder i.v. 1x/Woche, mit Folsäure-Substitution (5 mg p.o. 1-0-0)
- oder Mycophenolat 1 g/d p.o. 1-0-1
Bei akuter Lebensgefahr oder Beteiligung lebenswichtiger Organe (z.B. Nierenversagen, pulmorenales Syndrom, zerebrale Vaskulitis, Perimyokarditis) wird eine aggressive immunsuppressive Kombinationstherapie indiziert:
- Prednisolon 1 mg/kgKG p.o. (maximal 80 mg/d), innerhalb 12 Wochen auf 15 mg/d reduzieren, dann ausschleichen
- mit Cyclophosphamid als Bolustherapie oder nach FAUCI-Schema (2 mg/kgKG/d p.o. für 3–6 Monate)
- oder Rituximab (v.a. bei jungen Patienten): 375 mg/m2 Körperoberfläche i.v. als Infusion einmal wöchentlich für 4 Wochen, zuvor 3 Tage Prednisolon 1 g i.v., erste Gabe von Rituximab am 3. Tag der Prednisolontherapie
- Cotrimoxazol (400/80 mg/d) zur Pneumocystis-Prophylaxe
- Bei Gabe von Cyclophosphamid ist zur Zystitisprophylaxe die Applikation von MESNA indiziert.
In Notfallsituationen (z.B. dialysepflichtige Niereninsuffizienz, pulmonale Blutung) ist eine Plasmapherese und eine Hochdosis-Glukokortikoidgabe notwendig.
Bei therapierefraktäre Patienten wird Cyclophosphamid durch Rituximab ausgetauscht bzw. umgekehrt.
Remissionserhaltung
Die Remissionserhaltung erfolgt über mindestens 24 Monate nach Erreichen der Remission. Dabei wird eine Kombination aus Glukokortikoiden (Prednisolon 10 mg/d) und einem Immunsuppressivum verwendet:
- Azathioprin (1. Wahl): 2 mg/kgKG/Tag p.o.
- oder Rituximab: 500 mg i.v. einmalig als Infusion alle 6 Monate, zuvor 3 Tage Prednisolon 1 g i.v. und Gabe von Rituximab am 3. Tag der Prednisolontherapie
- oder Methotrexat: 25 mg p.o., s.c. oder i.v. einmal wöchentlich
- oder Mycophenolat (off label) 2 g/d
- oder Leflunomid (Reservemittel) 30 mg/d
Desweiteren kann ergänzend der C5aR-Antagonist Avacopan gegeben werden. Die zusätzliche Gabe von Cotrimoxazol (800/160 mg p.o. 1-0-1) kann das Rezidivrisiko senken und eine Dosiseinsparung bei Immunsuppressiva ermöglichen.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Prognose
Unbehandelt hat die GPA eine sehr schlechte Prognose und führt u.a. aufgrund der rapiden Nierenschädigung (RPGN) durchschnittlich innerhalb eines Jahres zum Tode. Unter optimaler Therapie ist die Prognose deutlich besser. So liegt die 5-Jahres-Überlebensrate dann bei über 85 %. In 75 % d.F. kommt es zur kompletten Remission, wobei Rezidive häufig sind.
Auch bei adäquater Therapie hat die GPA jedoch eine hohe Mortalität im 1. Jahr (ca. 10 %). Die häufigste Todesursache sind infektiöse Komplikationen im Rahmen der immunsuppressiven Therapie.
Literatur
- Guzman-Soto MI et al. From Head to Toe: Granulomatosis with Polyangiitis. Radiographics. 2021
- Ananthakrishnan L et al. Wegener's granulomatosis in the chest: high-resolution CT findings. AJR Am J Roentgenol. 2009
- Feragalli B et al. The lung in systemic vasculitis: radiological patterns and differential diagnosis. Br J Radiol. 2016
Quellen
- ↑ Watts, R.A., Ntatsaki, E.: Classification and epidemiology of vasculitis. In: Rheumatology. Hrsg. Hochberg, M. C. et al. Elsevier Philadelphia 7. Auflage 2019: 1341
| Peer-Review durch Bijan Fink |
um diese Funktion zu nutzen.