Liposom
Definition
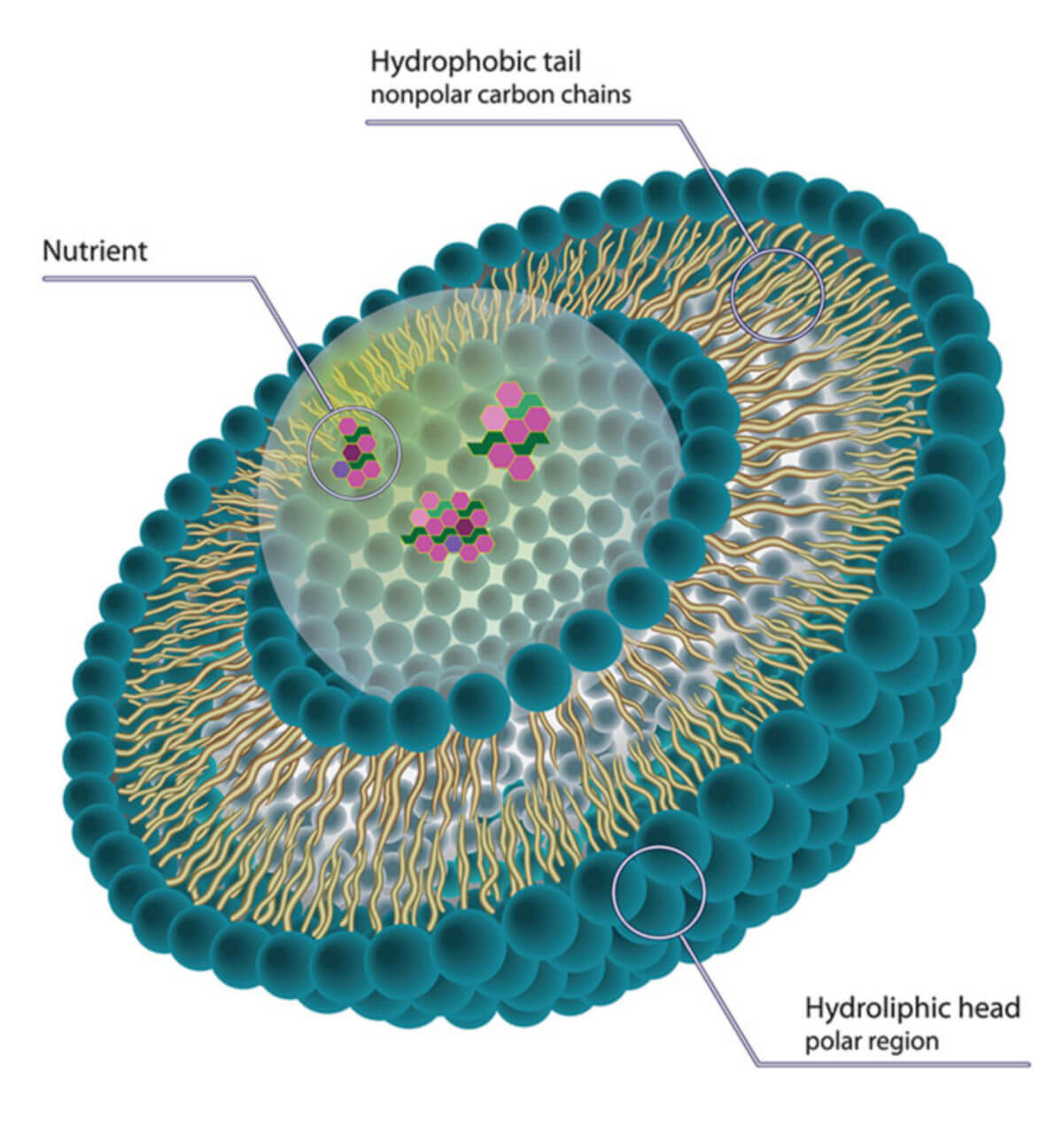
Liposomen sind kleine Vesikel, deren Hülle aus einer Lipiddoppelschicht besteht - ähnlich einer Zellmembran. Charakteristisch ist der amphiphile Charakter der Membranmoleküle - sie besitzten einen hydrophilen Kopf und einen hydrophoben Schwanz. Die rein optisch ähnlichen Mizellen besitzen nur eine einfache Lipidschicht. Liposomen werden in der Medizin und Pharmazie zum Transport von Arzneistoffen verwendet.
Geschichte
Die Entdeckung der Liposomen erfolgte im Jahr 1964 durch eine Gruppe von Wissenschaftlern um den britischen Hämatologen Alec Douglas Bangham am Babraham Institute.
Struktur
Liposomen bestehen aus einer Doppelschicht, die durch amphiphile Substanzen gebildet wird. Die hydrophoben Teile beider Moleküle sind zueinander gerichtet, während die hydrophilen Molekülteile nach außen bzw. innen zeigen. Ist das Dispersionsmedium lipophil, handelt es sich um sogenannte Reverse-Phase-Liposomen, deren Aufbau gegensinnig ist.
Untereinander sind die Membranmoleküle durch nichtkovalente Bindungen verbunden.
Einteilung
...nach chemischem Aufbau
Konventionelle Liposomen
Konventionelle Liposomen bestehen lediglich aus den Membranlipiden ohne spezielle Zusätze. Ihre Halbwertszeit ist kurz und es findet eine Verteilung in die Gewebe statt, vor allem in das retikuloendotheliale System (RES). Die Eliminierung erfolgt über das RES und über Opsonierung
Long-Circulating-Liposomen
Long-Circulating-Liposomen, auch Stealth-Liposomen genannt, werden PEGyliert, also kovalent an Polyethylenglykol gebunden. Der Begriff "Stealth-Liposom" ("Tarn-Liposom") kommt daher, dass die Liposomen nicht vom Immunsystem erkannt und eliminiert werden. Grund ist, dass die PEGylierung die Opsonierung verhindert. In Folge steigt die Halbwertszeit.
Durch die verlangsamte Ausscheidung und die Größe der Liposomen kann ein passives Drug Targeting vorliegen, bei dem die Liposomen in Tumorgewebe aufgenommen werden, da dieses durch seine Entartung größere Lücken im Endothel aufweist. Normale Gewebe haben ein geschlossenes Endothel, sodass die Liposomen nicht in diese gelangen können.
Immunliposomen
Bei Immunliposomen wird ein Antikörper an die Oberfläche der Liposomen gebunden. Dieser Antikörper bindet an ein bestimmtes Target (z.B. Oberflächenrezeptor eines Tumors) und bringt das Liposom auf diese Weise direkt zum Zielgewebe. Im Unterschied zu den Stealth-Liposomen liegt daher ein aktives Drug Targeting vor. Die Verknüpfung zwischen Liposom und Antikörper erfolgt über Maleimid.
Kationische Liposomen
Kationische Liposomen werden zur Transfektion von Antisense-RNA oder Genen verwendet. Durch die kationische Ladung können die Liposomen besser mit der Zellmembran interagieren, was deren Aufnahme in die Zelle und den Zellkern erleichtert. Das Verfahren wird auch als Lipofektion bezeichnet.
In Wirklichkeit haben kationische Liposomen jedoch weniger die Form eines klassischen Liposoms, sondern bilden eher ein Addukt aus Nukleinsäure und Lipid.
...nach Form und Größe
Folgende Formen an Liposomen werden unterschieden:
- Small Unilamellar Vesicles (SUV): Kleine Liposomen mit einer Membran, Größe 20 bis 100 nm
- Large Unilamellar Vesicles (LUV): Große Liposomen mit einer Membran, Größe über 100 nm
- Multilamellar Vesicles (MLV): Liposomen mit mehreren Membranen ("Zwiebelstruktur"), Größe 100 bis 1000 nm
- Multivesicular Vesicles (MVV): Mehrere Liposomen befinden sich in einem. Größe über 100 nm
Form und Größe der Vesikel sind von den Eigenschaften der sie umgebenden Phase und der genauen chemischen Zusammensetzung ihrer Membran abhängig. Die beste Verkapselungseffizienz für einen Wirkstoff haben MLVs, da bei diesen das Verhältnis von lipophiler zu hydrophiler Phase am größten ist.
Zusammensetzung
Liposomen bestehen aus amphiphilen Molekülen; pharmazeutisch genutzte bestehen im Speziellen aus Phospholipiden. Hierbei handelt es sich um ein Glycerol-Molekül, das mit zwei Fettsäuren und einem Molekül Phosphorsäure verestert ist. An der Phosphatgruppe können sich weitere Funktionalitäten befinden. Häufig werden folgende Stoffe verwendet:
- Wandbildner wie Phosphatidinylcholin oder Phosphatidinylethanolamin: Wandbildner sind der größte Anteil der Formulierung und bilden das eigentliche Lioposom.
- Cholesterin als Stabilisator: Cholesterin stabilisiert die Phospholipiddoppelmembran der Liposomen. Dies funktioniert analog zur physiologischen Funktion des Cholesterins: Sind die Fettsäuren zu dicht gepackt, erhöht Cholesterin deren Abstand und somit die Fluidität; sind die Fettsäuren zu weit entfernt, kann Cholesterin die Abstände überbrücken und so die Membran verfestigen.
- Ladungsträger wie Phosphatidinylglycerol oder -serin: Durch sie wird das Liposom stärker negativ geladen, was über eine Erhöhung der Abstoßungskräfte gemäß DLVO-Theorie zu einer besseren Stabilität führt. Die Ladungsträger selber sind nicht negativ geladen, sondern neutral. Sie kompensieren daher lediglich die positive Ladung der Wandbildner.
- weitere Hilfsstoffe wie Isotonierungsmittel (Natriumchlorid oder Glycerol) oder Antioxidantien (z.B. Tocopherol). Einige Hilfsstoffe wie die Isotonisierungsmittel können sich jedoch auch in der Lösung befinden, mit der die gefriergetrockneten Liposomen rekonstituiert werden.
Die Fluidität der Liposomenmembran nimmt großen Einfluss auf ihre Stabilität. Membranlipide können in einem flüssigkristallinen Zustand vorliegen, in dem die Membranbestandteile rasch lateral diffundieren können, und in einem gelkristallinen Zustand, in dem die laterale Diffusion eingeschränkt ist.
Bei Körpertemperatur sollten die Liposomen im gelkristallinen Zustand vorliegen - der Übergang zwischen den Zuständen wird durch die Schmelztemperatur beschrieben. Sie wird durch die Länge und den Sättigungsgrad der Fettsäuren, die Beschaffenheit der Kopfgruppen und den Anteil an Cholesterin bestimmt.
Herstellung
Zur Herstellung von Liposomen wurden diverse Verfahren entwickelt. Folgende Verfahren sind die am häufigsten angewandten:
- Lipidfilm-Verfahren: Dieses Verfahren wird vor allem im Labormaßstab verwendet. In einem organischen Lösungsmittel werden der Arzneistoff und die Membranlipide gelöst; diese Lösung wird in einem Rotationsverdampfer eingedampft. Es bleibt ein dünner Lipidfilm an der Innenwand des Kolbens zurück, der unter Rühren in Wasser dispergiert wird.
- solvent-exchange-Verfahren: Die Lipide und der Arzneistoff sind in einem organischen Lösungsmittel gelöst. Mit einer Spritze beziehungsweise Spritzeinheit wird ein Nicht-Lösemittel (in der Regel Wasser) dazugegeben, woraufhin die Lipide als Liposomen ausfallen. Ein Sonderfall hiervon ist die Ethanol-Verdünnung, bei welcher Ethanol das organische Lösungsmittel ist.
- Detergent-Removal-Verfahren: Als Ausgangssubstanzen dienen Mischmizellen, welche aus Wandbildner, Cholesterol und Cholsäuren bestehen. Werden diese Mizellen verdünnt, werden die Cholsäure-Moleküle aus den Mizellen entfernt, wobei sich diese zu Liposomen umwandeln.
Im Anschluss an die Herstellung werden die Liposomen in der Regel zerkleinert. Hierfür gibt es folgende Verfahren:
- Extrusion: Die Liposomen-Dispersion wird unter hohem Druck (bis zu 1000 bar) durch Polycarbonatkapillare mit definierter Porengröße (100 oder 200 nm) gepresst
- Mikrofluidisierung: Die Dispersion wird in zwei enge Kapillare geleitet, deren Flüssigkeitsströme unter hohem Druck aufeinanderprallen. Hierbei findet eine Zerkleinerung statt.
- Hochdruckhomogenisation: Die Liposomen werden etwa fünfmal mit hohem Druck (etwa 1000 bar) durch enge Kapillare oder Ringspalten gepresst.
In manchen Fällen werden die Liposomen schon während der Herstellung mit Arzneistoff befüllt, wenn Lipide und Arzneistoff in der selben Flüssigkeit gelöst werden. Manchmal werden die Liposomen jedoch erst nach ihrer Herstellung mit dem Arzneistoff beladen. Dies kann mit folgenden Methoden geschehen:
- Frier/Tau-Zyklen: Durch Einfrieren mit flüssigem Stickstoff und anschließendes Auftauen wird die Membranstruktur gestört, sodass Arzneistoff in das Liposom diffundieren kann.
- Phasenumkehr: Die Lipide werden in einem leicht verdampfbaren, organischen Lösungsmittel gelöst. Durch Zugabe einer wirkstoffhaltigen, wässrigen Lösung wird eine W/O-Emulsion gebildet. Wird das organische Lösungsmittel verdampft, kommt es zur Phasenumkehr mit Bildung wirkstoffhaltiger Liposomen.
- pH-Gradient: Bei diesem Verfahren wird das Prinzip des Ion trapping ausgenutzt. Der pH-Wert des Dispersionsmittels wird so gewählt, dass der Arzneistoff in das Liposom diffundieren kann. Im Innern des Liposoms herrscht jedoch ein anderer pH-Wert vor, sodass der Arzneistoff nicht wieder herausdiffundieren kann. Mit dieser Methode können Einschlusseffizienzen von bis zu 95% erreicht werden.
Nach der Herstellung werden Liposomen meist gefriergetrocknet, um die Lagerstabilität gewährleisten zu können.
Anwendungsgebiete
Liposomen werden hergestellt und mit bestimmten Arzneistoffen beladen. Die so entstehenden Arzneimittel werden als liposomal bezeichnet. Dies hat den Vorteil, dass der Wirkstoff dahin transportiert werden kann, wo er gebraucht wird. Dadurch sind in der Regel geringere Dosen notwendig - auch das Nebenwirkungsprofil wird günstig beeinflusst. Im Schutz der Vesikel transportiert, verlängert sich außerdem die Plasmahalbwertszeit der Wirkstoffe, die gleichzeitig vor einer verfrühten Metabolisierung geschützt werden.
Liposomale Arzneimittel
Folgende Wirkstoffe werden bereits in Form von Liposomen appliziert:
- Der Hepatitis A-Impfstoff Epaxal zur Prophylaxe der Hepatitis A, die in vielen Urlaubsländern, z.B. im Mittelmeerraum, vorkommt.
- Influvac, ein Impfstoff gegen das Influenza-Virus
- Morphin als Analgetikum im Rahmen von bestimmten postoperativen Schmerzen
- Amphotericin B als Antimykotikum gegen eine Reihe systemischer Pilzinfektionen
- Cytarabin gegen die maligne Meningeosis neoplastica
- Doxorubicin als Zytostatikum gegen ein metastasiertes Mammakarzinom, ein Multiples Myelom, ein Ovarialkarzinom oder ein HIV-assoziiertes Kaposi-Sarkom
- Daunorubicin, ebenfalls gegen das HIV-assoziierte Kaposi-Sarkom.
- Paclitaxel gegen ein Ovarialkarzinom.
- Verteporfin: Altersbedingte Makuladegeneration, Myopie
- Perflutren: Kontrastmittel für die Ultraschalluntersuchung
Literatur
Bauer, Frömmig, Führer: Pharmazeutische Technologie. Mit Einführung in die Biopharmazie. 10. Auflage, Stuttgart 2017