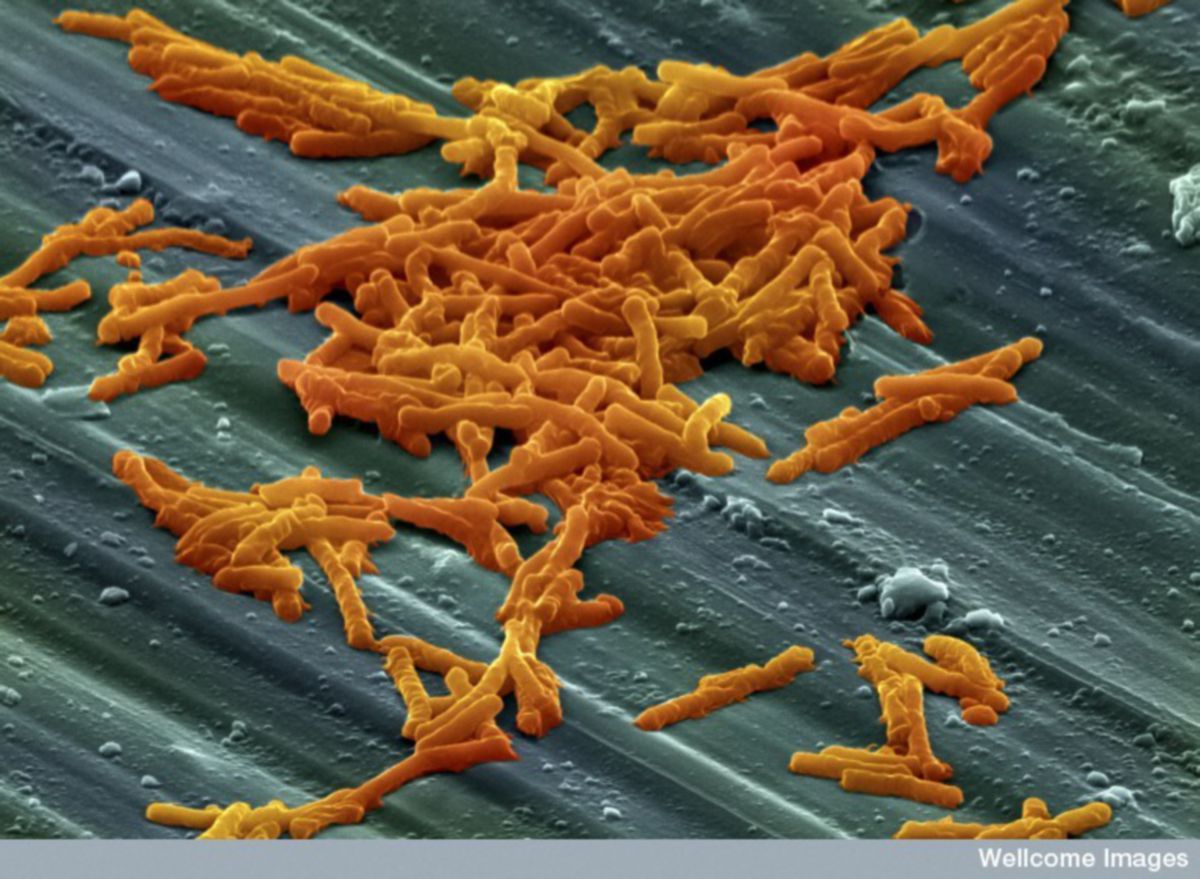
Clostridioides difficile
von altgriechisch: κλωστήρ ("kloster") - Spindel; lateinisch: difficile - schwierig
Synonyme: C. difficile, C. diff
Englisch: Clostridioides difficile
Definition
Clostridioides difficile, bis 2016 Clostridium difficile genannt, ist ein obligat anaerobes, bewegliches, gram-positives Stäbchenbakterium, das zur Sporenbildung befähigt ist. Das Bakterium ist einer der häufigsten Erreger von Nosokomialinfektionen.
Nomenklatur
Die ältere Bezeichnung "Clostridium difficile" ist in der medizinischen Alltagssprache nach wie vor (Stand 2025) weit verbreitet. Ein Grund dafür ist sicher die schlechte Sprechbarkeit des neuen Erregernamens.
Systematik
- Phylum: Bacillota
- Klasse: Clostridia
- Ordnung: Eubacteriales
- Familie: Peptostreptococcaceae
- Gattung: Clostridioides
- Art: Clostridioides difficile
- Gattung: Clostridioides
- Familie: Peptostreptococcaceae
- Ordnung: Eubacteriales
- Klasse: Clostridia
Mit dem Namen Clostridioides difficile wurde auch eine neue Gattung Clostridioides eingeführt, zu der außer Clostridioides difficile noch Clostridioides mangenotii gehört, das ebenfalls bisher zu den Clostridien gezählt wurde.[1] Die neue Klassifikation beruht auf Vergleichsstudien der 16S-rRNA-Sequenz.
Vorkommen
Clostridioides difficile kommt ubiquitär in der Umwelt und im Magen-Darm-Trakt von Menschen vor. Beim Menschen ist der Erreger häufig im Darm von Kleinkindern zu finden (bis zu 80 %). Erwachsene hingegen weisen nur eine geringere Besiedlung (unter 5 %) auf. Nach einem Krankenhausaufenthalt sind etwa 20 bis 40 % der Patienten mit Clostridioides difficile besiedelt, wobei sie häufig asymptomatisch bleiben.
Pathomechanismus
Clostridioides difficile produziert verschiedene Exotoxine, wie Enterotoxin A und Zytotoxin B, die zu einer Zerstörung der Epithelzellen der Darmschleimhaut führen. Beide Toxine sind Glucosyltransferasen, die GTPasen der Rho-Familie inaktivieren. Zytotxin B induziert dadurch eine Depolymerisation des Aktins. Weitere Toxine wurden beschrieben – ihre pathogenetische Bedeutung ist jedoch noch offen.
Zusätzliche Virulenzfaktoren von Clostridioides difficile sind Adhäsine, welche die Bindung an das Darmepithel vermitteln, und Hyaluronidase. Der Erreger sezerniert außerdem p-Kresol, um das Wachstum von anderen Mikroorganismen in seiner Umgebung zu unterdrücken. Damit verschafft er sich einen Selektionsvorteil gegenüber der normalen Darmflora.
In den letzten Jahren zeigte sich neben einem Anstieg der Inzidenz von Infektionen mit Clostridioides difficile auch das vermehrte regionale Auftreten von hochvirulenten Stämmen in Clustern, wie etwa dem Ribotyp 027. Beim Ribotyp 027 liegt eine Punktmutation (Deletion) im Toxingen vor, was schwere Krankheitsverläufe mit deutlich vermehrter Toxinexpression (A+B) zur Folge hat. Diese hochvirulenten Stämme weisen häufig Resistenzen gegen mehrere Antibiotika (z.B. Erythromycin oder Moxifloxacin) auf.
Übertragungsweg
Clostridioides difficile wird mit der Fäzes abgegeben und fäkal-oral zwischen Menschen, aber auch zwischen Tier und Mensch übertragen. Der Erreger kommt als Kommensale in der Darmflora vieler Patienten vor.
Das Bakterium bildet hitzeresistente Endosporen, die nicht durch gängige Händedesinfektionsmittel oder eine konventionelle Flächendesinfektion abgetötet werden. Die Sporen können daher auch in Gesundheitseinrichtungen lange Zeit überleben. Jede Oberfläche, die potentiell mit Fäzes kontaminiert ist (z.B. Toilettensitze, Badewannen), kommt dabei als Infektionsquelle infrage.
Nach der oralen Aufnahme der Sporen passieren sie aufgrund ihrer Säureresistenz den Magen, ohne vom Magensaft abgetötet zu werden. Im Colon keimen sie durch den Kontakt mit Gallensäuren und nehmen wieder ihre vegetative Form an, die sich auf der Darmschleimhaut vermehrt.
Klinik
Eine Infektion mit Clostridioides difficile (CDI) löst eine akute Darmentzündung (Enteritis) mit schleimig-blutigen Diarrhöen, Fieber und Bauchkrämpfen aus. Der Stuhl hat einen fötiden Geruch. Durchfall-bedingt kann es zu einer Exsikkose kommen.
In den meisten Fällen geht der Infektion eine Antibiotikatherapie voraus, die zu einer Störung der physiologischen Darmflora (Dysbiose) führt. Zu den am häufigsten beteiligten Antibiotika gehören Cephalosporine, Fluorchinolone, Aminopenicilline und Clindamycin.
Die Schwere der Clostridioides-difficile-assoziierten Diarrhö (CDAD) variiert stark. In der Mehrzahl der Fälle kommt es zu einem leichten bis mittelschweren Krankheitsverlauf. Die schwerste Verlaufsform imponiert unter dem Bild der pseudomembranösen Colitis mit der Ausbildung von Pseudomembranen auf den Colonwänden. Weiterhin ist die Entstehung eines toxischen Megacolon möglich.
Häufig geht eine Infektion mit Clostridioides difficile mit einer Hypoalbuminämie einher.
Nachweis
Als Screeningtest eignet sich das Clostridioides difficile-spezifische Enzym Glutamat-Dehydrogenase (GDH). Es wird sowohl von toxigenen als auch von nicht-toxigenen Stämmen produziert.
Die Infektion mit pathogenen Stämmen wird über den Nachweis der Toxine in einer Stuhlprobe belegt (Toxin A/B-Test). Er kann per Zellkultur (Hemmung des Zellwachstums) oder per ELISA erfolgen. Präanalytische Faktoren (lange Transportzeit, falsche Probenlagerung) können zu einem Toxinabbau führen und falsch negative Testergebnisse verursachen.
Die Kultivierung des Erregers ist aufwändig und nicht sinnvoll, da der Erreger auch bei Gesunden vorkommt.
Die pseudomembranöse Colitis kann endoskopisch durch eine Koloskopie diagnostiziert werden.
Therapie
Die antibiotische Therapie von Clostridioides-difficile-Infektionen (CDI) ist anspruchsvoll, da der Erreger Resistenzen entwickelt und sich der Therapie durch Sporenbildung und den schützenden Effekt der Pseudomembranen entzieht. Die hier gemachten Angaben sollten daher mit den aktuellen Empfehlungen abgeglichen werden, da sich die Resistenzsituation dynamisch weiterentwickelt.
Als Therapie der Wahl bei initialer CDI empfiehlt die S2k-Leitlinie (Stand 2025) eine Behandlung mit dem Schmalspektrumantibiotikum Fidaxomicin (Standarddosierung: 2 × 200 mg/Tag oral für 10 Tage), insbesondere bei erhöhtem Rezidivrisiko. Zu den Risiken zählen:[2]
- Alter > 65 Jahre
- vorhergehendes Rezidiv
- nosokomial erworbene CDI
- vorhergehende Hospitalisierung
- und/oder die Einnahme von Protonenpumpeninhibitoren während oder im Anschluss an eine CDI-Episode
Als Nachteil der Behandlung mit Fidaxomicin gelten die mit rund 1.700 Euro relativ hohen Kosten der Behandlung.[3] Zusätzlich kann eine Behandlung mit Bezlotoxumab (einmalig 10/mg/kgKG i.v.) zur Sekundärprophylaxe erfolgen.
Alternativ und bei nicht erhöhtem Rezidivrisiko kann Vancomycin (4 × 125 mg/Tag oral für 10 Tage) verschrieben werden.
Bei einem nicht schweren Krankheitsbild, fehlenden Risikofaktoren für einen schweren Krankheitsverlauf und guter Compliance des Patienten kann Metronidazol (3 × 400 mg/Tag oral für 10 Tage) eingesetzt werden.[2]
Bei rezidivierenden Verläufen empfiehlt die S2k-Leitlinie die Gabe von Fidaxomicin, entweder als Standarddosierung oder als verlängerte gepulste Gabe (2 × 200 mg Tag 1–5, 1 × 200 mg jeden 2. Tag für 20 Tage). Bei multiplen Rezidiven kann direkt im Anschluss an eine antimikrobielle Standardtherapie ein fäkaler Mikrobiotatransfer (FMT) in Betracht gezogen werden.[2]
Ist keine enterale Therapie möglich, sollte eine parenterale Therapie mit Metronidazol (3 x täglich 500 mg i.v.) oder Tigecyclin (2 x täglich 50 mg i.v.; Startdosis 100 mg i.v.) erfolgen. Bei einer komplizierten CDI wird eine notfallmäßige chirurgische Vorstellung empfohlen. Bei Patienten mit signifikanter Kolondilatation (> 6 cm) und/oder (Sub-)Ileus werden Fidaxomicin oder Vancomycin über eine Sonde verabreicht.[2]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Leitlinien
Quiz
Quellen
- ↑ Lawson PA et al: Reclassification of Clostridium difficile as Clostridioides difficile (Hall and O'Toole 1935) Prévot 1938. Anaerobe 2016; 40: 95-99
- ↑ 2,0 2,1 2,2 2,3 Manthey CF et al. S2k-Leitlinie Gastrointestinale Infektionen der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Version 2.1, 01.11.2023. AWMF-Registernummer: #021–024
- ↑ Gelbe Liste. DIFICLIR™ 200 mg Filmtabletten. Stand: 01.01.2024
Bildquelle
- Bildquelle für Flexikon-Quiz: © Vlada Karpovich / Pexels
Literatur
- Laborlexikon.de; abgerufen am 25.02.2021