AMX0035
Handelsnamen: Relyvrio® (USA), Albrioza® (Kanada), Elybrio® (Entwicklungspräparat, obsolet)
Definition
AMX0035 ist ein Kombinationstherapeutikum, das zur Therapie der amyotrophen Lateralsklerose (ALS) bei Erwachsenen eingesetzt wird.
Hintergrund
Bei der amyotrophen Lateralsklerose handelt es sich um eine rasch fortschreitende neurodegenerative Erkrankung des 1. und 2. Motoneurons, die mit progressiven schlaffen und spastischen Paresen, Faszikulationen, Fibrillationen sowie Schluck- und Sprechstörungen einhergeht.
Meist versterben die Patienten wenige Jahren nach Krankheitsmanifestation (mittlere Lebenserwartung beträgt ca. 3,5 Jahre) infolge einer respiratorischen Insuffizienz.
Neben der symptomatischen Therapie steht bisher (2024) nur die Gabe von Riluzol und Edaravon (nicht in Deutschland) zur Verfügung, um den Verlauf der ALS zu modifizieren.
Chemie
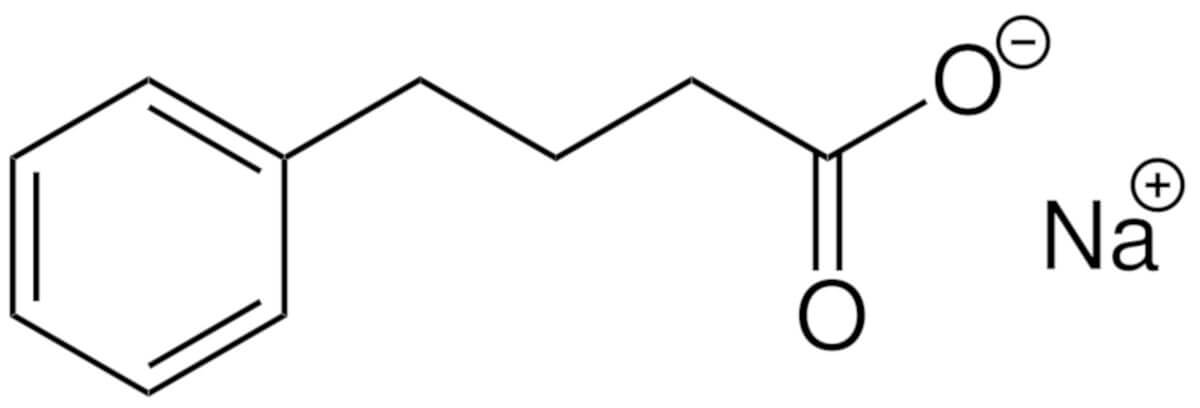
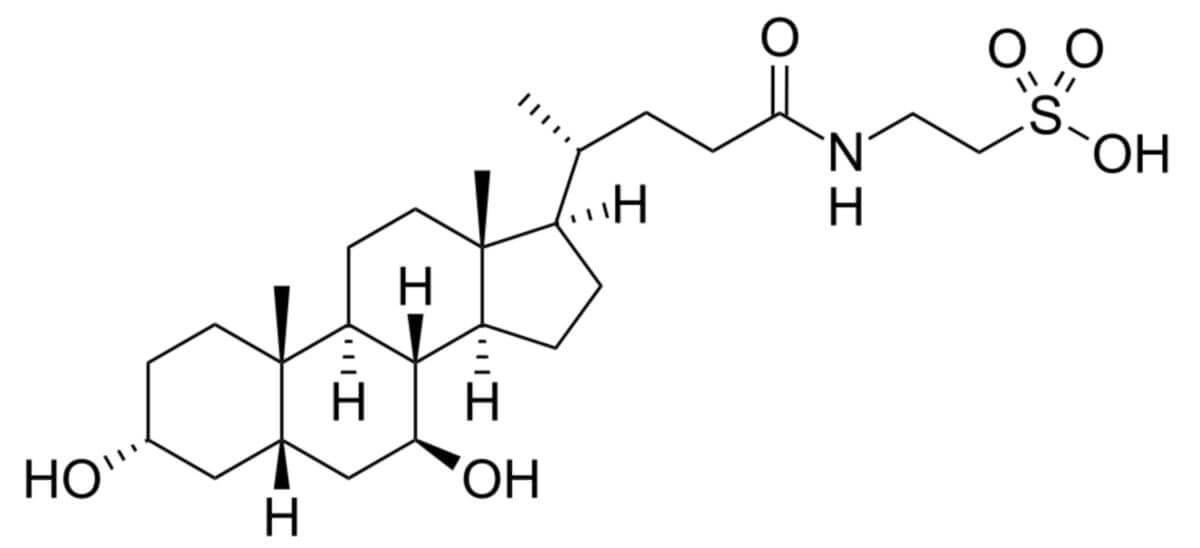
AMX0035 besteht aus den beiden Stoffen Natriumphenylbutyrat (PB) (C10H11NaO2; molare Masse: 186,2 g/mol) und Taurursodiol (TUDCA) (C26H45NO6S x 2H2O; molare Masse: 499,71 bzw. 535,74 g/mol)
Wirkmechanismus
AMX0035 behandelt nicht die Grundursache der ALS. Vielmehr zielt es darauf ab, die Motoneurone zu erhalten, die bei ALS zunehmend zugrunde gehen. Der genaue Wirkmechanismus ist unklar. Es wird angenommen, das AMX0035 Auswirkungen auf die Mitochondrien und das endoplasmatische Retikulum (ER) hat, die u.a. eine Schlüsselposition bei der Apoptose von Nervenzellen, sowie bei neuroinflammatorischen Prozessen innehaben. PB reduziert dabei wahrscheinlich den Stress auf das ER und vermindert die Akkumulation fehlgefalteter und mutierter Proteine, die zum Zelltod führen können. Bei TUDCA wird eine Erhöhung der Apoptoseschwelle durch eine Stabilisierung bioenergetischer Prozesse in den Mitochondrien vermutet. Insgesamt sollen somit sowohl der neuronale Zelltod, als auch die neurotoxische Inflammation durch AMX0035 verhindert bzw. gehemmt werden.[1]
Pharmakokinetik
Nach Aufnahme erreicht PB die maximale Plasmakonzentration nach durchschnittlich 0,5 h, TUDCA nach 4,5 h. Die Stoffe liegen zu 82 % und 98 % an Plasmaproteine gebunden vor. Die Metabolisierungs- und Eliminationswege wurden nicht final untersucht. Der Großteil (80 bis 100 %) von PB wird jedoch als konjugiertes Produkt innerhalb der ersten 24 h renal eliminiert.
Indikation
AMX0035 wird angewendet bei Patienten mit amyotropher Lateralsklerose im Erwachsenenalter.
Darreichungsform
Dosierung
Die Standarddosierung für AMX0035 ist ein Paket pro Tag für drei Wochen mit anschließender Erhöhung auf zwei Pakete pro Tag. Ein Paket enthält dabei 3 g Natriumphenylbutyrat und 1 g Taurursodiol.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Anwendungshinweise
AMX0035 sollte immer vor einer Mahlzeit verabreicht werden.
Nebenwirkung
Mögliche schwere Nebenwirkungen von AMX0035 sind eine Erhöhung des Gallensäurespiegels und Durchfälle. Dies betrifft vor allem Patienten mit bereits bestehenden Erkrankungen der Leber, der Gallenwege oder des Pankreas. Weiterhin kann AMX0035 durch einen hohen Salzanteil zur Natriumretention führen. Patienten die empfindlich auf erhöhte Natriumspiegel reagieren (z.B. bei Herzinsuffizienz, Hypertonie, Nierenerkrankungen) sollten ihre Salzzufuhr entsprechend einschränken. Weitere häufige Nebenwirkungen unter einer Therapie mit AMX0035 sind:
- Bauchschmerzen
- Übelkeit
- Infektionen der oberen Atemwege[2]
Wechselwirkung
Medikamente, die als Haupt- oder Nebenwirkungen den Gallensäurekreislauf beeinflussen, sollten vermieden bzw. individuell abgewogen werden (z.B. Colestyramin, Cyclosporin, aluminiumbasierte Antazida). Weitere Interaktionen sind u.a. mit P-Glykoprotein, CYP-Enzymen und Organo-Anion-Transportern sowie anderen Medikamenten und Enzymen bekannt.
Kontraindikationen
Es liegen keine wesentlichen Kontraindikationen für eine Therapie mit AMX0035 vor. Patienten mit intestinalen und kardiovaskulären Vorerkrankungen sind besonders zu überwachen. Eine Gabe von AMX0035 bei Patienten mit ausgeprägter Nieren- oder Leberinsuffizienz sollte vermieden werden. Zur Anwendung bei Schwangeren, Stillenden und Kindern wurden noch keine Daten zur Beurteilung etwaiger Nebenwirkungen erhoben.
Forschung
Die Wirksamkeit und Sicherheit vom AMX0035 wurde von 2017 bis 2021 in der von dem Pharmaunternehmen Amylyx Pharmaceuticals Inc. durchgeführten CENTAUR-Studie (NCT03127514) untersucht. Dabei wurden 137 ALS-Patienten randomisiert in eine Placebo- und eine AMX0035-Gruppe aufgeteilt, wobei nach sechs Monaten alle Patienten in einer entblindeten Weiterführung das Verum erhielten. Gemessen wurde die Sterberate sowie die funktionelle Einschränkung anhand der ALS Functional Rating Scale (ALSFRS). Insgesamt zeigte sich unter der Behandlung mit AMX0035 eine verlangsamte Krankheitsprogression, eine spätere Hospitalisierung und Beatmung sowie ein vermindertes Sterberisiko. Die Patienten lebten im Schnitt 11,5 Monate länger bzw. 6,4 Monate, wenn sie das Verum erst in der entblindeten Weiterführung erhalten haben.
Eine weitere Phase-III-Studie (PHOENIX) in den USA und Europa sollte die Ergebnisse der CENTAUR-Studie reproduzieren. Dabei konnten die relevanten Endpunkte jedoch nicht erreicht werden.[3]
Zulassung
AMX0035 ist ein Präparat des Herstellers Amylyx Pharmaceuticals Inc. Es ist seit Juni 2022 in Kanada und seit September 2022 in den USA zugelassen. Die EMA hat eine Zulassung im Juni 2023 aufgrund von Zweifeln an der Wirksamkeit abgelehnt. Es sei nicht ausreichend belegt, dass das Fortschreiten der Krankheit effektiv verlangsamt werden könne. Die Daten zur Gesamtüberlebenszeit wurden als nicht verlässlich eingestuft.[4]
Kosten
Die Kosten für eine Therapie mit AMX0035 liegen monatlich bei 12,500 $ (USA) bzw. 13,340 $ (Kanada). Die jährlichen Kosten belaufen sich auf 158,000 $ (USA) und 162,400 $ (Kanada).
Quellen
- ↑ BioPharma Media, Relyvrio/Albrioza: New Drug for Amyotrophic Lateral Sclerosis Treatment, abgerufen am 09.12.2022
- ↑ Amylyx, Amylyx Pharmaceuticals Announces FDA Approval of RELYVRIO™ for the Treatment of ALS, abgerufen am 09.12.2022
- ↑ Amyotrophe Lateralsklerose: Relyvrio enttäuscht in Phase-3-Studie, Deutsches Ärzteblatt , 11. März 2024
- ↑ Refusal of the marketing authorisation for Albrioza (sodium phenylbutyrate / ursodoxicoltaurine). EMA/279343/2023. Abgerufen am 05.07.2023
Literatur
- FDA, Relyvrio, abgerufen am 09.12.2022
- DocCheck, ALS: Ein halbes Jahr länger leben, abgerufen am 21.12.2022
- ALS-Charité, PHOENIX-STUDIE (AMX0035), abgerufen am 21.12.2022
- ClinicalTrials.gov, AMX0035 in Patients With Amyotrophic Lateral Sclerosis (ALS) (CENTAUR), abgerufen am 21.12.2022