Lipoprotein
Definition
Als Lipoproteine bezeichnet man makromolekulare Komplexe aus Proteinen (Apolipoproteinen) und Lipiden (Cholesterin, Triglyzeriden, Phospholipiden, fettlösliche Vitaminen).
Hintergrund
Die Komplexbildung als Lipoprotein dient dem Transport der hydrophoben Lipide durch wässrige Körperflüssigkeiten (Plasma, Lymphe, interstitielle Flüssigkeit). Lipoproteine übernehmen dabei quasi die Rolle eines Emulgators.
Sie besitzen insbesondere folgende Funktionen:
- Aufnahme von Cholesterin, langkettigen Fettsäuren und fettlöslichen Vitaminen aus der Nahrung
- Transport von Triglyzeriden, Cholesterin und fettlöslichen Vitaminen von der Leber in die peripheren Gewebe
- Transport von Cholesterin von den peripheren Geweben in die Leber und den Darm
Biochemie
Struktur
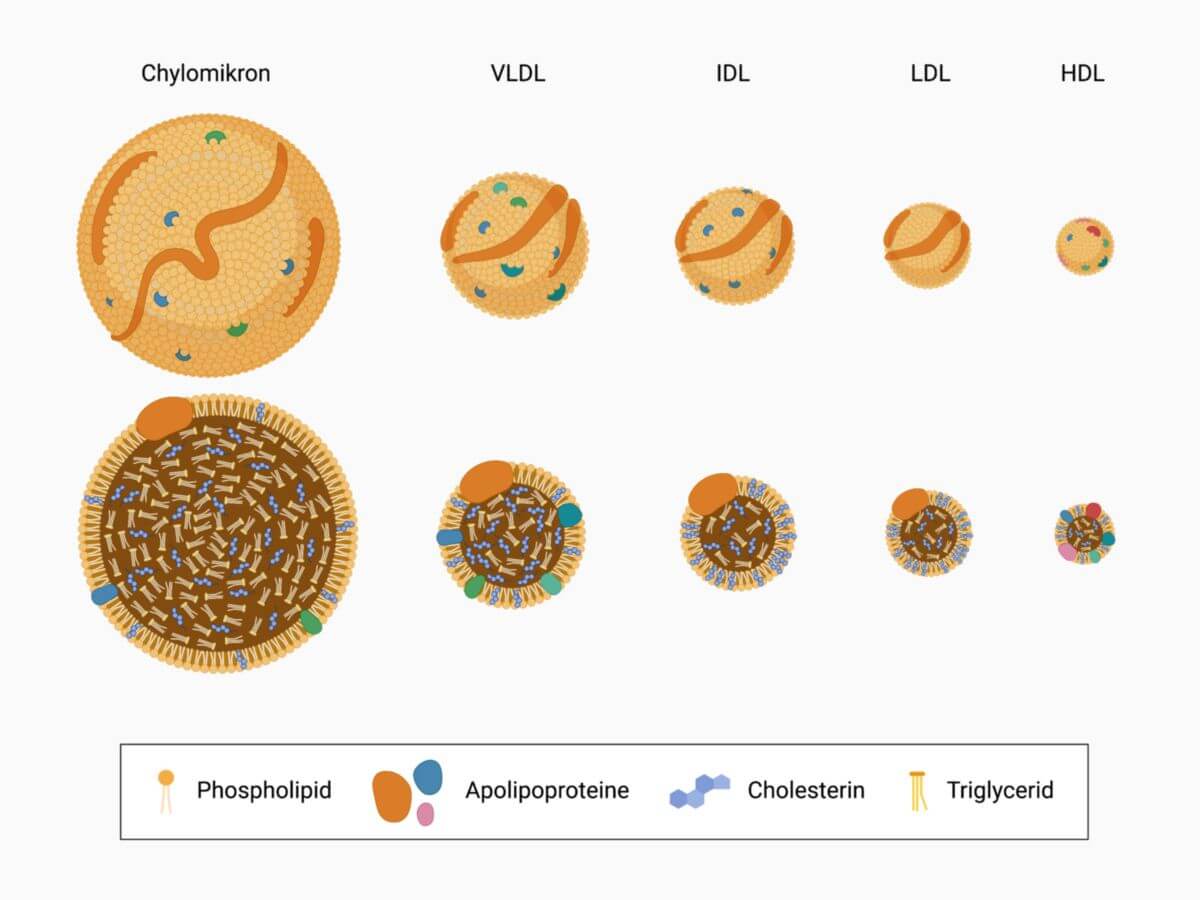
Lipoproteine enthalten einen Kern aus hydrophoben Lipiden (Triglyzeriden, Cholesterinester), umgeben von hydrophileren Lipiden (Phospholipiden, nicht verestertes Cholesterin) und Proteinen (Apolipoprotein). Die nichtkovalente Interaktion zwischen den Molekülen führt zur Pseudomizellen-Bildung.
Einteilung
...nach Dichte
Lipoproteine im Plasma werden anhand ihrer relativen Dichte bei der Ultrazentrifugation in mehrere Klassen eingeteilt:
- Chylomikronen
- Very Low Density Lipoprotein (VLDL)
- Intermediate Density Lipoprotein (IDL)
- Low Density Lipoprotein (LDL)
- Lipoprotein (a) (Lp(a))
- High Density Lipoproteins (HDL)
Jede Klasse umfasst eine Familie von Partikeln mit unterschiedlicher Dichte, Größe und Proteinzusammensetzung. Die Dichte wird insbesondere durch den Lipidanteil pro Partikel bestimmt: Chylomikronen enthalten am meisten Lipide und sind daher am wenigsten dicht.
...nach Größe
Weiterhin können Lipoproteine nach ihrer Größe eingeteilt werden. Diese wird mittels nicht denaturierender Gelelektrophorese oder Kernspinresonanz-Spektrometrie bestimmt. Die größten Partikel haben die geringste Dichte.
...nach Mobilität
Die elektrophoretische Bewegung der Partikel im Agarose-Gel ist abhängig von der Größe und der Oberflächenladung der Partikel. Als β wird die Position von LDL, als α die von HDL definiert.
| Lipoprotein | Dichte (g/ml) | Größe (nm) | Mobilität | Apolipoproteine | weitere Bestandteile |
|---|---|---|---|---|---|
| Chylomikronen | 0,930 | 75 - 1200 | Ausgangspunkt |
|
Retinylester |
| Chylomikronen-Remnants | 0,930 - 1,006 | 30 - 80 | Slow Prä-β | ||
| VLDL | 0,930 - 1,006 | 30 - 80 | prä-β |
|
Vitamin E |
| IDL | 1,006 - 1,019 | 25 - 35 | Slow Prä-β |
| |
| LDL | 1,019 - 1,063 | 18 - 25 | β | ||
| HDL | 1,063 - 1,210 | 5 - 12 | α |
|
|
| Lipoprotein (a) | 1,050 - 1,120 | 25 | Prä-β |
|
oxidierte Phospholipide |
Apolipoproteine
Die Apolipoproteine sind für die Zusammenlagerung, Struktur und Funktion der Lipoproteine notwendig. Sie aktivieren Enzyme des Lipoproteinmetabolismus wie die Lipoproteinlipase (LPL) und agieren als Liganden für Rezeptoren an der Zelloberfläche. Die meisten Apolipoproteine werden im Blut aktiv zwischen den einzelnen Lipoproteinen ausgetauscht.
- ApoB ist das Hauptstrukturprotein der Chylomikronen sowie von VLDL, IDL und LDL. Auf diesen Lipoproteinen findet sich entweder ein Molekül ApoB-48 (z.B. auf Chylomikronen) oder ApoB-100 (VLDL, IDL, LDL). ApoB 100 wird in der Leber gebildet, ApoB 48 im Darm. Beide entstammen vom selben Gen und entstehen durch unterschiedliche mRNA-Prozessierungen.
- Fast alle HDL-Partikel besitzen ApoA-I aus Leber und Darm. ApoA-II ist das zweithäufigste HDL-Apolipoprotein (ca. 2/3 der HDL-Partikel).
- Weiterhin existieren ApoC-I, C-II und III, die am Metabolismus triglyzeridreicher Partikel beteiligt sind.
- ApoE spielt bei dem Metabolismus und der Clearance der triglyzeridreichen Partikel eine wichtige Rolle.
| Apolipoprotein | Hauptquelle | assoziiertes Lipoprotein | Funktion |
|---|---|---|---|
| ApoA-I | Darm, Leber | HDL, Chylomikronen | Strukturprotein der HDL; Aktivierung der LCAT |
| ApoA-II | Leber | HDL, Chylomikronen | Strukturprotein der HDL; Bindung an Scavenger-Rezeptor B1 |
| ApoA-IV | Darm, Leber | HDL, Chylomikronen | LCAT-Aktivator |
| ApoA-V | Leber | VLDL | Unterstützung des LPL-vermittelten Triglyzerid-Abbaus |
| Apo(a) | Leber | Lp(a) | unbekannt |
| ApoB-48 | Darm | Chylomikronen, -Remnants | Strukturprotein der Chylomikronen; Interaktion mit LDL-Rezeptor in Hepatozyten |
| ApoB-100 | Leber | VLDL, IDL, LDL, Lp(a) | Strukturprotein der VLDL, LDL, IDL und Lp(a); Ligand für den LDL-Rezeptor |
| ApoC-I | Leber | Chylomikronen, VLDL, HDL | Aktivator der LCAT; Hemmung des CETP |
| ApoC-II | Leber | Cofaktor für die Lipoproteinlipase (LPL) | |
| ApoC-III | Leber, Darm | Hemmung der LPL-Aktivität; Lipoproteinbindung an Rezeptoren | |
| ApoE | Leber | Chylomikronen-Remnants, IDL, HDL | Ligand u.a. für den LDL-Rezeptor |
Lipoproteinstoffwechsel
Exogener Weg
Der Transport von Nahrungslipiden aus dem Darm in andere Bereiche des Körpers ist notwendig, um Fettsäuren zur Energiegewinnung zu nutzen bzw. um Lipide zu speichern und zu verstoffwechseln. Die Triglyzeride aus der Nahrung werden durch Lipasen hydrolysiert und mit Gallensäuren emulgiert. Cholesterin, Fettsäuren und Retinol (Vitamin A) werden im Dünndarm resorbiert. In den Enterozyten werden Cholesterin und Retinol zu Cholesterin- bzw. Retinylestern umgewandelt.
Langkettige Fettsäuren (d.h. über 12 C-Atome) werden in Triglyzeride eingebaut und mit ApoB-48, Cholesterinestern, Retinylestern, Phospholipiden und Cholesterin beladen. Dadurch entstehen Chylomikronen, die über die Lymphe in den großen Blutkreislauf gelangen.
In Blutgefäßen des Fettgewebes sowie der Herz- und Skelettmuskulatur treffen die Chylomikronen auf die endothelständige Lipoproteinlipase, die an das Protein GPIHBP1 gebunden ist. Die LPL hydrolysiert Triglyzeride aus den Chylomikronen, sodass Fettsäuren freigesetzt weren. ApoC-II (von HDL auf die zikulierenden Chylomikronen transferiert) agiert bei dieser Reaktion als Kofaktor.
Die freien Fettsäuren werden von den Fett- bzw. Muskelzellen aufgenommen, um Energie zu gewinnen (β-Oxidation) oder um diese als Triglyzeride zu speichern. Einige Fettsäuren binden Albumin und werden zur Leber transportiert.
Da der hydrophobe Kern hydrolysiert wird, nehmen die Chylomikronen an Größe ab. Ihre hydrophilen Lipide (Cholesterin, Phospholipide) werden zu den HDL transferiert, sodass Chylomikronen-Remnants entstehen, die zur Leber gelangen.
Endogener Weg
In der Leber werden langkettige Fettsäuren zu Triglyzeriden verestert. Diese werden zusammen mit ApoB-100, Cholesterinester, Phospholipiden und Vitamin E zu VLDL zusammengelagert. Dafür ist das mikrosomale Transferprotein (MTP) notwendig.
Nach der Sekretion ins Plasma enthalten VLDL-Partikel viel ApoE und ApoC von den HDL-Partikeln. Wie bei Chylomikronen werden die Triglyzeride der VLDL mittels Lipoproteinlipase (v.a im Fettgewebe, Herz- und Skelettmuskel) hydrolysiert. Die dadurch entstehenden VLDL-Remnants werden als IDL bezeichnet. Nun enthalten sie ungefähr gleiche Mengen an Cholesterin und Triglyzeriden (vorher 1:5).
Die Leber entfernt ca. 40 bis 60 % der IDL nach Bindung von ApoE an den LDL-Rezeptor der Hepatozyten. Der Rest der IDL wird durch die hepatische Lipase umgebaut, sodass LDL entsteht. Bei diesem Prozess werden Phospholipide und Triglyzeride hydrolysiert und alle Apolipoproteine außer ApoB-100 auf andere Lipoproteine transferiert.
Die LDL-Partikel werden zu 70 % wieder von der Leber abgebaut. In diesem Fall bindet ApoB an den LDL-Rezeptor der Hepatozyten.
Lipoprotein(a) ist ein Lipoprotein, das sich von LDL nur durch das zusätzliche Apolipoprotein(a) unterscheidet. Apo(a) wird in der Leber gebildet und über eine Disulfidbrücke an ApoB-100 gebunden. Zwar wird Lp(a) insbesondere in der Leber abgebaut, der Aufnahmeweg ist jedoch aktuell (2019) unklar. Das Plasmaspiegel ist hauptsächlich genetisch determiniert.
Reverser Cholesterintransport
Zwar kann Cholesterin in jedem Gewebe synthetisiert werden, jedoch kann es nur von Hepatozyten und Enterozyten effektiv über Galle bzw. Stuhl aus dem Körper entfernt werden. Dafür muss Cholesterin aus den peripheren Geweben durch den HDL-vermittelten reversen Cholesterintransport zur Leber transportiert werden, wo es direkt oder nach Konversion in Gallensäuren in die Gallenflüssigkeit sezerniert wird.
Leber und Darm bilden naszente HDL-Partikel. Das neu gebildete ApoA-I nimmt mit Hilfe des Proteins ABCA1 Phospholipide und Cholesterin auf. Dadurch entstehen diskoidale HDL-Partikel, die nun zusätzliches Cholesterin aus Zellen oder zirkulierenden Lipoproteinen rekrutieren. Im HDL-Partikel wird das Cholesterin durch das Enzym LCAT verestert, sodass diese hydrophoben Lipide in das Innere des Partikels wandern. Im Verlauf wird HDL somit sphärisch. Zusätzliche Apolipoproteine und Lipide von Chylomikronen und VLDL werden ebenfalls in die HDL-Partikel transferiert.
HDL wird nun auf zwei Wegen zu den Hepatozyten transportiert:
- direkter Weg: HDL wird über den Scavenger-Rezeptor Klasse B1 (SR-B1) in die Hepatozyten aufgenommen
- indirekter Weg: HDL-Cholesterinester werden via CETP gegen Triglyzeride ausgetauscht und somit zu ApoB-enthaltenden Lipoproteinen (VLDL, Chylomikronen) transferiert. Die Cholesterinester werden dann über den LDL-Rezeptor in die Leber aufgenommen.
siehe Hauptartikel: Reverser Cholesterintransport
Pathologie
Krankheiten des Lipoproteinstoffwechels werden im Allgemeinen als Dyslipidämien bezeichnet. Die meisten Patienten weisen eine Kombination aus genetischer (meist polygener) Prädisposition und externen Faktoren (Lebensstil, Krankheiten, Medikamente) auf. Bei vielen besteht dabei ein erhöhtes Risiko für die Entwicklung einer Arteriosklerose. Bei Patienten mit erhöhten Triglyzeridwerten besteht hingegen ein erhöhtes Risiko einer Pankreatitis.
siehe Hauptartikel: Fettstoffwechselstörung
Podcast

Bildquelle
- Bildquelle Podcast: ChatGPT (DocCheck)