Humanes Leukozytenantigen
Synonyme: Humanes Leukozyten-Antigen, HL-Antigen, Gewebsantigen, Histokompatibilitätsantigen, Transplantationsantigen, MHC-Antigen
Englisch: human leukocyte antigen, major histocompatibility complex antigen
Definition
Humane Leukozytenantigene, kurz HLA, sind in der Zellmembran verankerte Komplexe aus Glykoproteinen, die als Antigene eine individuelle "Signatur" der Zelle bilden. Dadurch wird eine Unterscheidung zwischen körpereigenen und körperfremden Strukturen durch das Immunsystem möglich. Die HLA werden v.a. von Genen des Haupthistokompatibiliätskomplexes kodiert und der Immunglobulin-Superfamilie zugerechnet.
Terminologie
Der Begriff Haupthistokompatibilitätskomplex (MHC) wird speziesübergreifend genutzt. Die MHC-Systeme verschiedener Spezies haben jeweils eigene Namen. Das MHC-System des Menschen wurde zuerst an Leukozyten beschrieben, wo es besonders stark exprimiert wird, und wird daher als humanes Leukozytenantigen-System bezeichnet.
Nomenklatur
Das HLA-System wurde im Laufe der Zeit erweitert und die Nomenklatur mehrfach geändert.[1] Grundsätzlich sind Serotypenbezeichnungen (z.B. HLA-DR4), die antikörperbasiert bestimmt wurden, von Genotypenbezeichnungen (z.B. HLA-DRB1*04:01) zu unterscheiden, die auf molekulargenetischen Untersuchungen (u.a. mittels PCR) beruhen.
Das derzeit (2025) verwendete System zur Benennung der HLA-Allele basiert auf den Empfehlungen des HUGO Gene Nomenclature Committee (HGNC). Dabei hat jedes HLA-Allel eine eindeutige Bezeichnung, die bis zu vier durch Doppelpunkte getrennte Ziffernsätze enthält. Alle Allele haben mindestens eine vierstellige Nummerierung, bestehend aus den ersten beiden Zifferngruppen. Längere Bezeichnungen werden nur bei Bedarf vergeben und verwendet. Die Nomenklatur wird im Folgenden anhand des Beispiels "HLA-B*44:02:01:02S" veranschaulicht.[1][2][3]
- HLA-: Präfix (mit Bindestrich, um diesen vom Gennamen zu trennen)
- B: Genname
- bei Klasse-II-Molekülen zusätzlich der Buchstabe A oder B für die schwere oder leichte Kette (z.B. HLA-DRB)
- *: trennender Asterisk
- 44: Allelgruppe
- 02: spezifische Kennzeichnung der Aminosäuresequenz / Reihenfolge der Entdeckung
- 01: synonyme DNA-Variation innerhalb der kodierenden Region
- 02: Variation in einer nicht-kodierenden Region
- S: Suffix, das zur Bezeichnung von Veränderungen der Expression verwendet wird
Mögliche Suffixe sind:[3]
- N ("null"): es wurde keine Expression der Allele gezeigt
- L ("low"): geringe Expression auf der Zelloberfläche
- S ("secreted"): sezerniertes Molekül, das sich jedoch nicht auf der Zelloberfläche befindet
- C ("cytoplasm"): Nachweis des Proteins im Zytoplasma und nicht auf der Zelloberfläche
- A ("aberrant"): es besteht Zweifel, ob das Protein exprimiert wird
- Q ("questionable"): es ist nicht bekannt, ob sich die Mutation auf die normale Expression auswirkt
Da in serologischen Untersuchungen der genaue Genotyp nicht bestimmt werden kann, sind die Bezeichnungen der Serotypen kürzer. Sie werden in einem ähnlichen, aber vereinfachten Schema angegeben (Beispiel: HLA-DR4):
- HLA: Präfix
- DR: Genname
- 4: Subtyp (Cave: entspricht nicht immer der Allelgruppe; HLA-DR2 entspricht z.B. den Allelvarianten HLA-DRB1*15 und *16)
Serotyp-Genotyp-Äquivalenzen sind in Datenbanken gelistet.[4]
Genetik
Die für die HLA kodierenden Gene finden sich größtenteils im HLA-Komplex, einem Genkomplex bestehend aus etwa 4 Millionen Basenpaaren in der Nähe des Centromers auf Chromosom 6. Eine Ausnahme bildet das β2-Mikroglobulin-Gen, das sich auf Chromosom 15 befindet.
Pro haploidem Chromosomensatz finden sich entweder 10 oder 11 verschiedene HLA-Gene (sogenannter Haplotyp):[5][6][7]
- HLA-Ia-Gene: kodieren für drei Isotypen der α-Kette des MHC-I-Komplexes
- β2-Mikroglobulin-Gen: kodiert für die β-Kette des MHC-I-Komplexes
- HLA-II-Gene: kodieren für drei Isotypen der α-Kette und drei bis vier Isotypen der β-Kette des MHC-II-Komplexes
Die HLA-Gene verhalten sich kodominant zueinander, was bedeutet, dass die von beiden Elternteilen ererbten Allele exprimiert werden.
Die meisten HLA-Gene zeichnen sich durch eine hohe Variabilität auf zwei Ebenen aus:
- Polygenie: es existieren auf beiden Chromosomen mehrere Isotypen
- Polymorphismus: es existieren sehr viele Allelvarianten eines Isotyps in der Population
Ausnahmen bilden das β2-Mikroglobulin (keine Polygenie) und der HLA-DRA-Isotyp (kaum Polymorphismus).[7]
Durch die hohe Genvariabilität und die Kombination mütterlicher und väterlicher Allele entsteht eine sehr hohe Zahl möglicher Konstellationen aus HLA-Merkmalen. Sinn dieser starken Variabilität ist, zu verhindern, dass Krankheitserreger durch Anpassung an ein bestimmtes HLA-Merkmal der T-Zell-Abwehr entgehen.[6]
Merkmale
Beim HLA-System unterscheidet man mehrere Klassen von HLA-Merkmalen, wobei die membrangebundenen Klassen I und II die Hauptrolle spielen.
HLA-Klasse-I-Merkmal
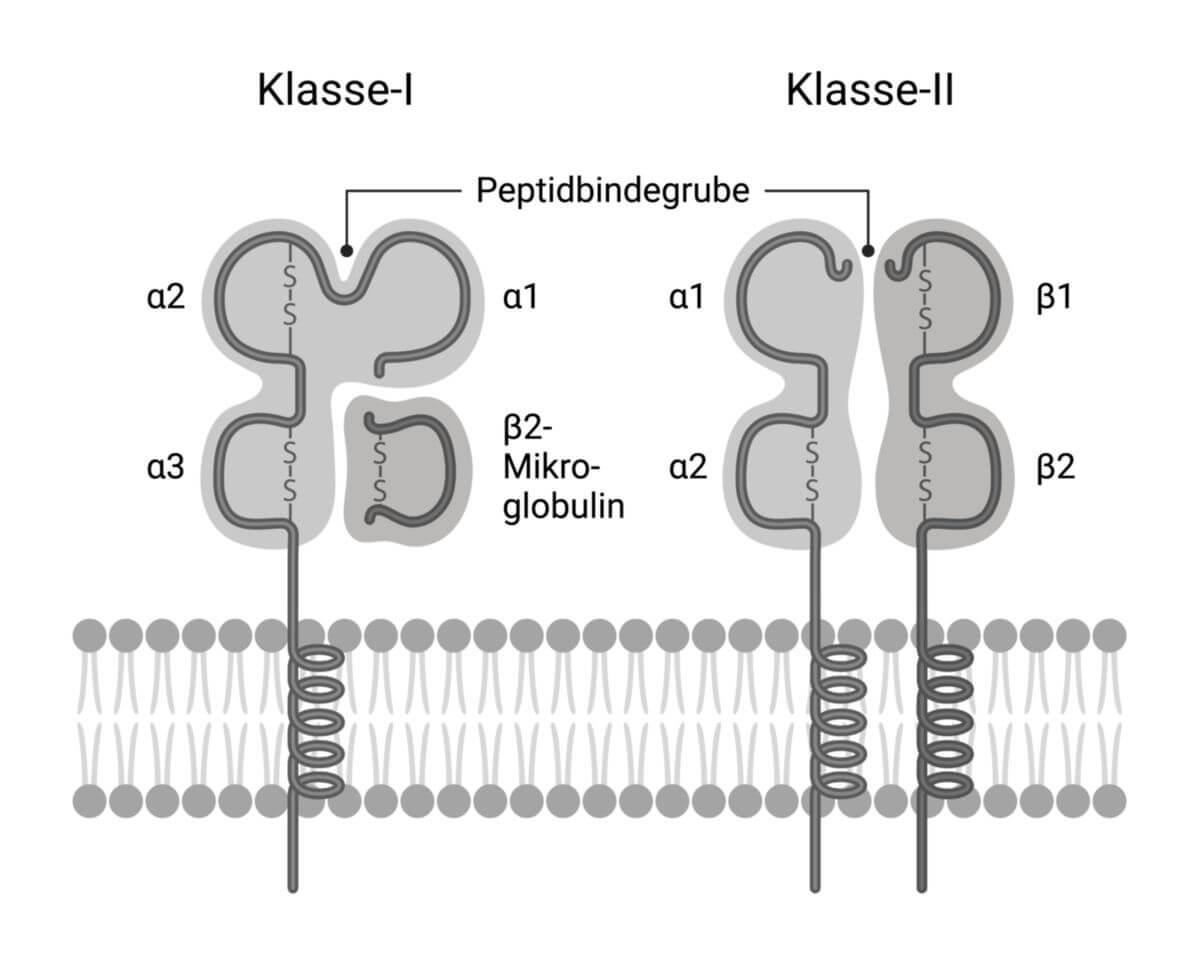
HLA-Klasse-I-Moleküle (MHC-I-Rezeptoren) bestehen aus einer transmembranär an der Zelloberfläche verankerten α-Kette, an die auf der extrazellulären Seite ein β2-Mikroglobulin angelagert ist. Im gesamten Molekül lassen sich 4 Abschnitte oder "Domänen" unterscheiden: Die α-Kette stellt 3 Domänen (α1 bis α3), das β2-Mikroglobulin die vierte Domäne des Komplexes.
Die 3 extrazellulär gelegenen Alpha-Proteinketten zeigen eine hohe Variabilität in der Aminosäuresequenz, während das Beta-2-Mikroglobulin-Protein der konstante Teil ist. Wie alle Membranproteine weist die membranständige Alpha-3-Domäne einen hydrophoben Teil auf, der zytoplasmatische Teil eine polare Aminosäure, vornehmlich Tyrosin, das phosphoryliert wird, und so zur Regulierung des Rezeptors beiträgt. Die extrazellulären Teile des Moleküls (α1 und α2) bilden 2 Arme (Helices) aus, die am Boden durch sogenannte Beta-Ketten verbunden sind und eine Grube bilden, mit der Peptide gebunden werden können. Die Grube ist räumlich klein und kann Peptide mit bis zu 10 Aminosäuren binden. Diese Peptide sind üblicherweise Fragmente, die beim Abbau von zelleigenen Proteinen im Proteasom gebildet und an der Zelloberfläche immunkompetenter Zellen (beispielsweise CD8+-T-Lymphozyten) präsentiert werden. Auf diese Weise lassen sich körpereigene von fremden Zellen unterscheiden. HLA-Klasse-I-Moleküle finden sich auf nahezu allen kernhaltigen Körperzellen sowie auf den Thrombozyten, lediglich der Trophoblast trägt keine MHC-I-Komplexe.
HLA-Klasse-II-Merkmal
HLA-Klasse-II-Moleküle (MHC-II-Rezeptoren) bestehen aus einer schweren α-Kette und einer leichten β-Kette. Im Gegensatz zu den Klasse-I-Molekülen sind hier beide Ketten in der Zellmembran verankert. Das Molekül besteht aus 4 extrazellulären Domänen (α1 und α2 sowie β1 und β2). Auch dieser Komplex bildet eine Grube, die von der α1- und β1-Domäne geformt wird. Auf der Außenseite der β2-Kette bindet das Co-Rezeptor-Protein CD4. Die Grube ist etwas größer als die der HLA-Klasse-I-Moleküle. Der Rezeptor kann Antigene von einer Größe bis zu 20 Aminosäuren aufnehmen.
HLA-Klasse-II-Moleküle finden sich nur auf antigenpräsentierenden Zellen, wie B-Zellen, phagozytierenden Zellen (z.B. Makrophagen) und dendritischen Zellen der Haut (Langerhans-Zellen).
Die im Rahmen der Phagozytose aufgenommenen Proteine und Peptide werden lysosomal abgebaut, am glatten endoplasmatischen Retikulum mit dem MHC-II-Rezeptor verbunden und in der Außenmembran des Makrophagen zusammen mit dem CD-4-Rezeptor präsentiert, an den die T-Helfer-Zellen (CD4⁺-T-Lymphozyten) andocken. Erst dann können die T-Helfer-Zellen immunologisch aktiv werden, indem die humorale Immunantwort in den B-Lymphozyten induziert wird und Zytokine sezerniert werden, die das Phagozytoseverhalten der Makrophagen stimulieren.
| Klasse | Klasse-I | Klasse-II |
|---|---|---|
| Struktur |
|
|
| Präsentierte Peptide |
|
|
| Vorkommen | alle kernhaltigen Zellen | Antigen-präsentierende Zellen |
| Isotypen | HLA-A, -B und -C | HLA-DP, -DQ, -DR, -DN und -DO |
| Involvierte Immunzellen | CD8+-T-Lymphozyten | CD4+-T-Lymphozyten |
HLA-Klasse-III-Merkmal
Zu den Klasse-III-Molekülen gehören die Komplementfaktoren C2 und C4 sowie Komplementfaktor B. Im Gegensatz zu den anderen Klassen handelt es sich hierbei um Plasmaproteine, die an der unspezifischen Immunabwehr beteiligt sind. Dass sie zu den HLA-Merkmalen gerechnet werden, verdanken sie dem Umstand, dass ihre Gene auf dem kurzen Arm von Chromosom 6 zwischen die Gene der Klassen I und II eingestreut sind.
Medizinische Bedeutung
HLA-Merkmale dienen der Bestimmung der Histokompatibilität, die für den Erfolg von Transplantationen entscheidend ist. Je ähnlicher sich die HLA-Merkmale von Spender und Empfänger sind, desto geringer ist die Gefahr von Abstoßungsreaktionen. Identische HLA-Merkmale finden sich nur bei eineiigen Zwillingen oder Klonen.
Eine weitere wichtige Bedeutung kommt den HLA-Antigenen durch die HLA-Typisierung zu. Ihr liegt die Erkenntnis zugrunde, dass viele Krankheiten mit bestimmten HLA-Antigenen assoziiert sind. Dadurch lassen sich Rückschlüsse auf das Krankheitsrisiko ziehen. Beispiele für HLA-Varianten, die mit bestimmten Erkrankungen assoziiert sind, sind HLA-B27, HLA-DR2, HLA-DR3, HLA-B13 oder HLA-C06.
Auch in der Pharmakologie sind die HLA-Merkmale relevant. So haben z.B. bestimmte Patientengruppen (Angehörige der Han-Ethnie oder der Thai-Ethnie) mit der Antigenvariante HLA-B*1502 unter Phenytoin ein erhöhtes Risiko für schwerwiegende Hautreaktionen (SJS, TEN).
Weblinks
- Vereinfachte Struktur der HLA Gen-Region, abgerufen am 19.11.2021
- Universität Pecs - Vorlesung zu Grundlagen der Immunologie, abgerufen am 19.11.2021
Einzelnachweise
- ↑ 1,0 1,1 Hurley, Naming HLA diversity: A review of HLA nomenclature. Human Immunology, 2021.
- ↑ Braschi et al. Genenames.org: the HGNC and VGNC resources in 2019. Nucleic Acids Research. 47(D1):D786-792. 2019
- ↑ 3,0 3,1 Nomenclature for Factors of the HLA System, Anthony Nolan Research Institute, Stand 2019. Aufgerufen am 13.08.2024.
- ↑ The HLA Dictionary Tool, European Molecular Biology Laboratory, 2024. Aufgerufen am 14.08.2024.
- ↑ Institut für Medizinische Diagnostik Berlin-Potsdam, Genetik und immunologische Funktionen des HLA-Systems. Aufgerufen am 28.06.2024.
- ↑ 6,0 6,1 Murphy, Weber, Janeway Immunologie. 9. Auflage, Springer Verlag, 2018. S. 294ff.
- ↑ 7,0 7,1 Mak, Saunders, MHC: The Major Histocompatibility Complex, in The Immune Response - Basic and Clinical Principles. Elsevier Academic Press, 2006. Seite 267ff.