Thrombopoietin
Synonyme: Thrombopoetin, Megakaryozytenwachstumsfaktor, Meg-CSF
Englisch: thrombopoietin, megakaryocyte growth and developement factor, MGDF
Definition
Thrombopoietin, kurz TPO, ist ein hormonell aktives Glykoprotein, das zu den Zytokinen gezählt wird. Es stimuliert im menschlichen Knochenmark die Bildung und Differenzierung der Megakaryozyten, aus denen die Blutplättchen (Thrombozyten) entstehen.
Genetik
Das für Thrombopoetin kodierende Gen (THPO-Gen) befindet sich auf Chromosom 3 im Genlokusbereich q26.3–27, auf dem langen Arm des Chromosoms. Mutationen des Gens können zu einer Leukämie führen. Auch Fälle einer angeborenen Thrombozytose sind durch den Gendefekt bekannt. Die bekannteste Folge einer Mutation des THPO-Gens ist eine essentielle Thrombozythämie.
Biochemie
Thrombopoetin ist ein Peptidhormon, das aus 332 Aminosäuren besteht. Verglichen mit anderen Zytokinen ist es relativ lang. Die N-terminale Domäne besitzt eine große Ähnlichkeit mit Erythropoietin. Sie wird deshalb auch als "EPO-Domäne" bezeichnet. Das Polypeptid weist insgesamt eine starke Glykosylierung auf und besitzt ein Molekulargewicht von etwa 70 kDa. Es existieren drei Konstitutionsisomere.
Funktion
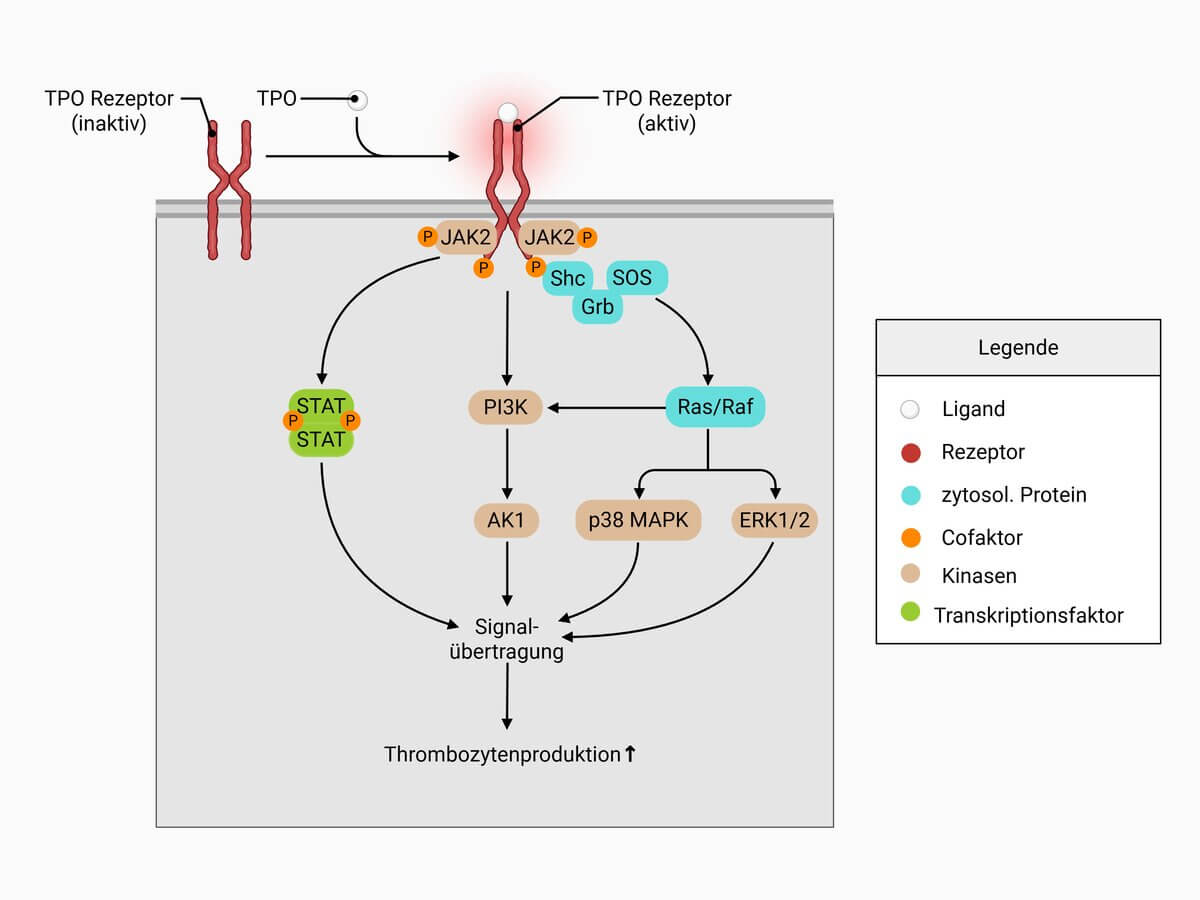
Thrombopoietin wird in der Leber und der Niere, sowie in der quergestreiften Muskulatur und in den Stromazellen des Knochenmarks gebildet. Es nimmt an verschiedenen Stellen Einfluss auf den Ablauf der Hämatopoese, wobei der Einfluss auf die Differenzierung der Megakaryozyten und die Thrombozytopoese am stärksten ausgeprägt ist. Die Wirkung von Thrombopoietin wird dabei über den Thrombopoietin-Rezeptor (CD110) in der Zellmembran der Megakaryozyten vermittelt.
Die Bindung von TPO an CD110 führt zur Dimerisierung des Rezeptors, wodurch eine Konformationsänderung ausgelöst wird. Diese Strukturveränderung aktiviert die an die intrazelluläre Domäne des Rezeptors gebundenen Januskinasen (JAKs), insbesondere JAK2. JAK2 phosphoryliert sich zunächst selbst (Autophosphorylierung) und anschließend den Rezeptor sowie verschiedene nachgeschaltete Signalmoleküle.
An die durch Phosphorylierung entstehenden Tyrosinreste des Rezeptors binden nun Signalproteine, v.a. Mitglieder der STAT-Familie (z.B. STAT1, STAT3 und STAT5). Parallel werden über Adapterproteine wie Shc, Grb und SOS weitere Signalkaskaden aktiviert.
Zu den wichtigsten aktivierten Signalwegen zählen der JAK-STAT-Signalweg, der zur Translokation der STAT-Proteine in den Zellkern und damit zur Regulation spezifischer Zielgene führt, der MAPK/ERK-Signalweg, der Zellproliferation und Differenzierung vermittelt, sowie der PI3K/AKT-Signalweg, der Zellüberleben und Wachstum fördert.
Der hormonelle Regelkreis des Thrombopoietin unterscheidet sich von dem der meisten anderen Hormone. Er wird im Wesentlichen von der Anzahl der verfügbaren Rezeptoren gesteuert. Nach erfolgreicher Thrombozytopoese wird das Thrombopoeitin auch von CD110 auf der Thrombozyten-Oberfläche gebunden – dadurch steht weniger Hormon zur Aktivierung der Megakaryozyten zur Verfügung.
Diagnostik
Der Thrombopoetin-Spiegel ist im Blut messbar. Dabei ist dieser Gehalt durch o.g. Regulationsmechanismen umgekehrt proportional zur Anzahl an Thrombozyten. Ein hoher Anteil an Blutplättchen bedingt einen niedrigen Spiegel des Hormons.
Pathophysiologie
Der Pegel an freiem Thrombopoetin kann unter bestimmten pathologischen Gegebenheiten erniedrigt oder auch erhöht sein. Dies ist insbesondere der Fall bei:
- Infektionen
- Leberversagen bzw. bestimmte Lebererkrankungen
- Entzündungen
- Störungen der Hämatopoese als Folge von Knochenmarkserkrankungen
Klinik
Im Gegensatz zum Erythropoietin wird rekombinantes Thrombopoietin (rhTPO) in Europa zur Zeit (2025) noch nicht therapeutisch eingesetzt.
Es gibt vier als Arzneimittel zugelassene Thrombopoietin-Rezeptor-Agonisten, Eltrombopag, Romiplostim, Avatrombopag und Lusutrombopag, die unter anderem zur Therapie der Immunthrombozytopenie (ITP) verwendet werden.