Ritlecitinib
Handelsname(n): Litfulo®
Englisch: ritlecitinib
Definition
Ritlecitinib ist ein Tyrosinkinasehemmer aus der Gruppe der JAK-Inhibitoren, der zur Therapie der Alopecia areata eingesetzt wird. Im Rahmen klinischer Studien wird er auch zur Behandlung anderer Autoimmunerkrankungen (Rheumatoide Arthritis, Morbus Crohn, Colitis ulcerosa und Vitiligo) untersucht.
Chemie
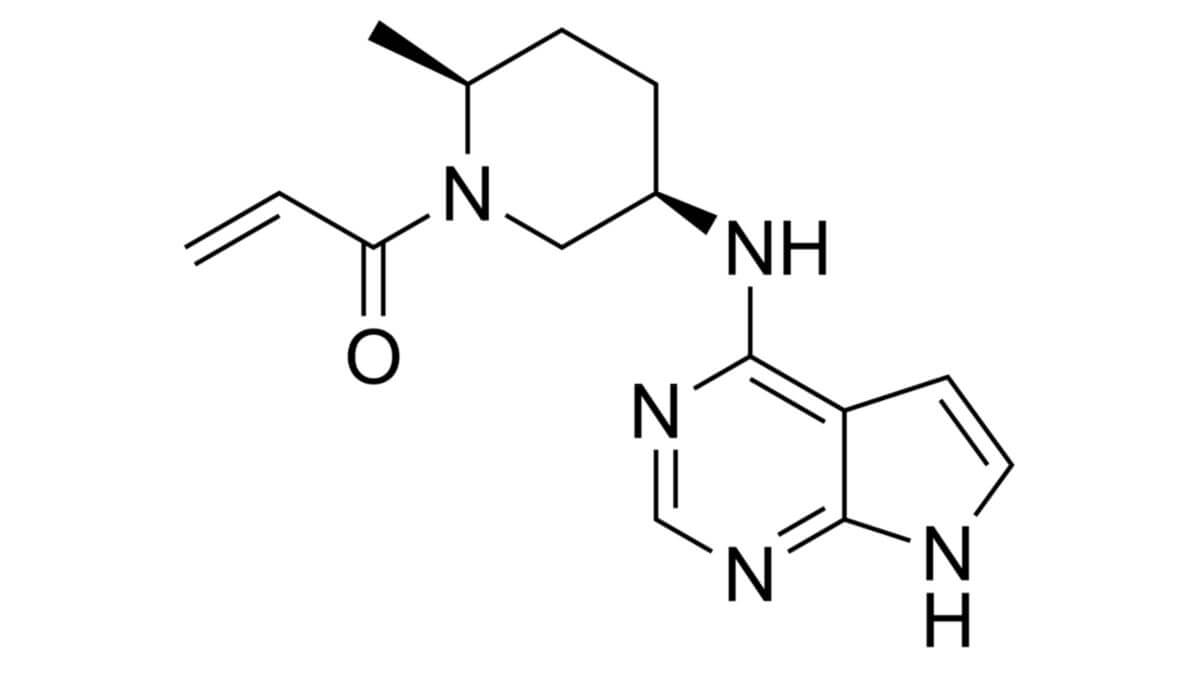
Ritlecitinib weist ein 7-Deazaadenin-Grundgerüst auf, das an der exozyklischen Aminogruppe mit einem 2-Methylpiperidin derivatisiert ist. Dessen Stickstoffatom ist über eine Amidbindung mit Acrylsäure gekoppelt.
Der Wirkstoff imitiert das Adenin des ATP als physiologisches Substrat der Kinasen. Auf diese Weise wird Ritlecitinib in die Bindetasche der Enzyme aufgenommen. Dort reagiert der Wirkstoff über die Doppelbindung des Acrylamids im Rahmen einer Michael-Addition, sodass sich ein kovalentes Enzym-Wirkstoff-Addukt bildet, das funktionsunfähig ist.
Die Summenformel lautet C15H19N5O; das Molekulargewicht beträgt 285,35 g/mol. Pharmazeutisch wird das Tosylatsalz verwendet.[1]
Wirkmechanismus
Eine Alopecia areata entsteht dadurch, dass die Haarfollikel vom Immunsystem angegriffen werden. Ritlecitinib hemmt selektiv und irreversibel die JAK3- und TEC-Kinasen, die in die Entzündungsprozesse involviert sind. Dadurch wird die immunvermittelte Entzündung der Haarfollikel verringert und Haare können nachwachsen. Wegen dieses Wirkmechanismus zählt Ritlecitinib wie andere Januskinasehemmer zu den Immunsuppressiva.[2] [3]
Pharmakokinetik
Die orale Bioverfügbarkeit beträgt 64 %, ohne dass Nahrungsmittel einen klinisch relevanten Einfluss auf die Absorption haben. Das Verteilungsvolumen liegt bei 74 l, die Plasmaproteinbindung bei 14 %. Die Verstoffwechselung erfolgt über Glutathion-S-Transferasen und CYP-Enzyme (CYP3A4, CYP2C8, CYP1A2, CYP2C9). Die Eliminationshalbwertszeit beträgt 1,3 bis 2,3 Stunden.[4]
Indikation
- schwere Alopecia areata bei Erwachsenen und Jugendlichen ab 12 Jahren[4]
Darreichungsform
Ritlecitnib ist als Hartkapsel mit 50 mg Ritlecitinib erhältlich.
Dosierung
Die empfohlene Dosierung beträgt 50 mg einmal täglich. Wenn nach 36 Behandlungswochen keine Besserung auftritt, ist ein Therapieabbruch in Betracht zu ziehen. Während der Therapie sollte die Thrombozyten- und Lymphozytenzahl überwacht werden.[4]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Da Ritlectinib ein Immunsuppressivum ist, besteht unter der Therapie eine erhöhte Infektionsneigung und die Gefahr schwerer Infektverläufe, z.B. einer Sepsis. Bei Patienten, die an einer chronischen Infektionskrankheit leiden oder per se ein erhöhtes Infektionsrisiko tragen, ist der Einsatz des Arzneimittels abzuwägen. Vor Therapiestart sollte der Patient auf das Vorliegen einer Tuberkulose untersucht werden. Darüber hinaus kann es zur Reaktivierung von Varizella-Zoster-Viren mit Herpes zoster kommen. Andere, leichtere Infektionen, die gemeldet wurden, sind Nasopharyngitis und Atemwegsinfekte.
Weitere mögliche Nebenwirkungen sind:
- Maligne Erkrankungen: Unter der Therapie mit Ritlecitinib entwickelten manche Patienten maligne Erkrankungen, z.B. nicht-melanozytären Hautkrebs.
- Schwere kardiovaskuläre Ereignisse (MACE): tiefe Venenthrombose, Lungenembolie
- Lymphozytopenie
- Thrombozytopenie
- Kopfschmerzen
- Schwindel
- Durchfall
- Akne, Urtikaria, Ausschlag
Wechselwirkungen
Da Ritlecitinib ein mäßig starker Inhibitor von CYP3A4 ist, sollten CYP3A4-Substrate mit enger therapeutischer Breite mit Vorsicht angewandt werden (z.B. Chinidin, Ciclosporin). Dasselbe gilt für Substrate von CYP1A2 (z.B. Tizanidin) und OCT1 (z.B. Sumatriptan). Die gleichzeitige Einnahme von CYP-Inhibitoren bzw. -Induktoren führt nicht zu klinisch signifikanten Änderungen der Ritlecitinib-Exposition.
Die Schutzwirkung durch Impfstoffe kann während der Einnahme des Medikaments verringert sein.
Kontraindikationen
- Überempfindlichkeit gegen den Wirkstoff
- aktive und schwere Infektionen (z.B. Tuberkulose)
- schwere Leberfunktionsstörungen
- Schwangerschaft und Stillzeit
Zulassung
Die Zulassung in der EU erfolgte im September 2023.
Nutzenbewertung
In der Indikation "Verbesserung des Haarwuchses" wurde Ritlecitinib vom G-BA als Lifestyle-Arzneimittel in die Anlage II der Arzneimittelrichtlinie aufgenommen. Damit ist der Arzneistoff für diese Indikation nicht mehr zu Lasten der gesetzlichen Krankenversicherung (GKV) verordnungsfähig.[5]
ATC-Code
- L04AF08
Quellen
- ↑ Ritlecitinib toslate, pubchem; aufgerufen am 11.11.2023
- ↑ Litfulo (Rilecitinib): Übersicht über Litfulo und warum es in der EU zugelassen ist, European Medicines Agency (EMA); aufgerufen am 11.11.2023
- ↑ Ritlecitinib, gelbe Liste online; aufgerufen am 11.11.2023
- ↑ 4,0 4,1 4,2 Litfulo: Zusammenfassung der Merkmale des Arzneimittels (Fachinformation); aufgerufen am 11.11.2023
- ↑ Arzneimittel-Richtlinie/Anlage II: Tirzepatid (Mounjaro®) und Ritlecitinib (Litfulo®). G-BA Beschluss 19.09.2024, abgerufen am 25.09.2024