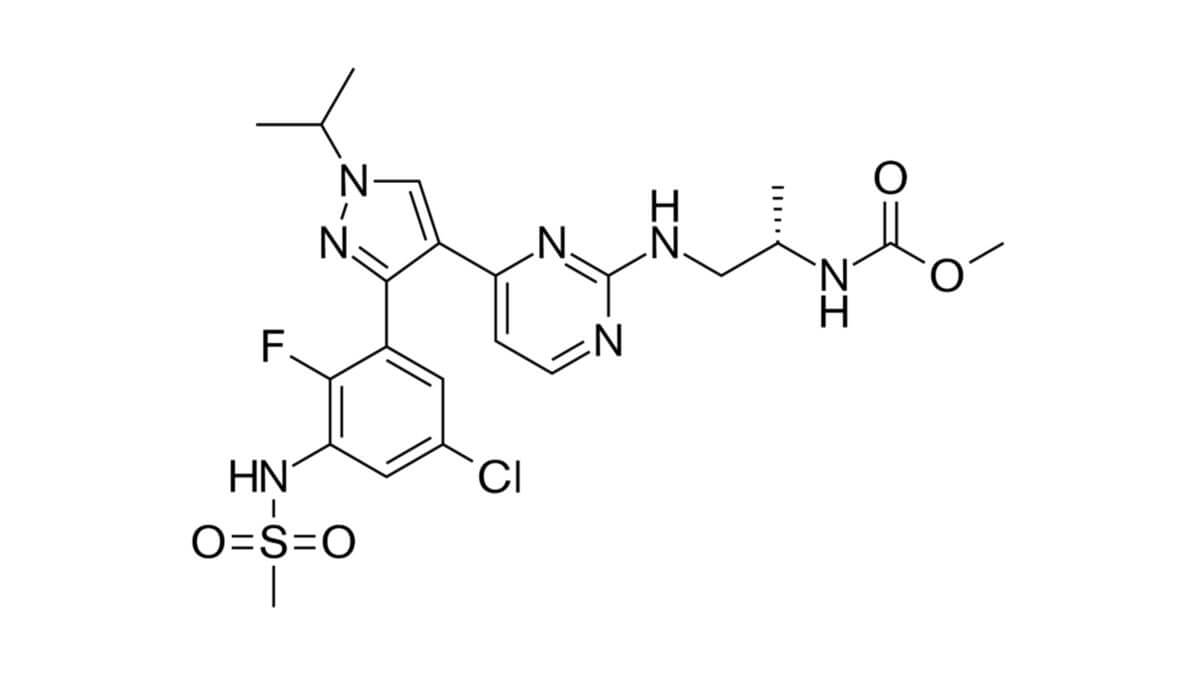
Encorafenib
Handelsname: Braftovi®
Synonym: LGX818
Englisch: encorafenib
Definition
Encorafenib ist ein Serin/Threonin-Kinase-Hemmer aus der Klasse der BRAF-Inhibitoren. Der Arzneistoff wird in der Onkologie unter anderem zur Behandlung von malignen Melanomen mit einer BRAF-V600-Mutation angewendet.[1]
Chemie
Die Summenformel von Encorafenib lautet C22H27Cl1F1N7O4S1 und das Molekulargewicht beträgt 540,01 g/mol.[2]
Wirkmechanismus
Encorafenib hemmt selektiv das Protoonkogen BRAF, das bei einigen malignen Tumoren in mutierter Form vorliegt. BRAF spielt eine wichtige Rolle im Ras/Raf/MAPK-Signalweg, der an der Steuerung des Zellwachstums beteiligt ist. Eine Mutation im BRAF-Gen kann eine Überaktivität des Signalwegs auslösen, was zu unkontrolliertem Zellwachstum und damit zur malignen Transformation der Zelle führt.
Durch Bindung an das durch Mutation veränderte BRAF werden von diesem Signalweg abhängige Transkriptionsfaktoren nicht mehr aktiviert und es kommt zum Abbruch der Transkription. Die Proliferation der Tumorzellen wird gehemmt und der onkogene Signalweg unterbrochen.
Encorafenib zeigt eine hemmende Wirkung gegen BRAF V600E, V600D, V600K und gegen CRAF-Enzyme (RAF-1).[1]
Encorafenib wird in Kombination mit ?Binimetinib, einem MEK-Inhibitor, eingesetzt. Die Kombination führt zu einer Hemmung des MAPK-Signalwegs an zwei Positionen, was zu einer Erhöhung der antineoplastischen Aktivität führt. Darüber hinaus wird durch die Kombination die Resistenzentwicklung verlangsamt.
Pharmakokinetik
Die Zeit bis zum Erreichen der maximalen Plasmakonzentration beträgt nach der oralen Einnahme von Encorafenib etwa 2 Stunden. Der Steady State wird nach rund 15 Tagen erreicht. Die Eliminationshalbwertszeit von Encorafenib liegt bei rund 6 Stunden.[1]
Die mittlere inhibitorische Konzentration (IC50) von Encorafenib gegen BRAF V600E liegt bei 0,35 nM. Die Dissoziationshalbwertszeit ist größer als 30 Stunden.
Indikation
- Kombinationstherapie mit Binimetinib von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation
- Kombinationstherapie mit Cetuximab von erwachsenen Patienten mit systemisch vorbehandeltem Kolorektalkarzinom mit einer BRAF-V600-Mutation
- In Kombination mit Binimetinib bei erwachsenen Patienten mit fortgeschrittenem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit einer BRAF-V600EMutation.
Voraussetzung für die Anwendung ist der Nachweis einer BRAF-V600-Mutation durch Sequenzierung des Tumorgenoms.[1]
Darreichungsform
Der Arzneistoff ist in Form von Hartkapseln mit einem Wirkstoffgehalt von 50 oder 75 mg erhältlich.[1]
Dosierung
Die empfohlene Dosierung von Encorafenib richtet sich nach der Indikation und der jeweiligen Kombinationstherapie.[1]
- Malignes Melanom und nicht-kleinzelliges Bronchialkarzinom: 450 mg Encorafenib einmal täglich in Kombination mit Binimetinib
- Kolorektalkarzinom: 300 mg einmal täglich in Kombination mit Cetuximab
Die Einnahme kann unabhängig von den Mahlzeiten erfolgen.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Folgende Nebenwirkungen treten unter der Einnahme von Encorafenib sehr häufig (≥ 1:10) oder häufig (≥ 1:100) auf:[1]
- gutartige und bösartige Neubildungen: Papillom, Melanom
- Stoffwechsel: verminderter Appetit
- Nervensystem: Kopfschmerzen, Neuropathie, Dysgeusie
- Blutsystem: Anämie
- Immunsystem: Überempfindlichkeit
- Psyche: Insomnie
- Herz: Tachykardie
- Gastrointestinaltrakt: Nausea, Erbrechen, Diarrhö, Obstipation, Pankreatitis
- Haut/ Unterzellgewebe: Hyperkeratose, Haarausfall, Exanthem, Hand-Fuß-Syndrom, Pruritus, Erythem, Dermatitis
- Skelettmuskulatur: Arthralgie, Myalgie, Arthritis
- Nieren und Harnwege: Nierenversagen
- Allgemein: Fatigue, Pyrexie
- Labormedizinisch: Anstieg von ALT, AST, CPK und Lipase
Wechselwirkungen
Encorafenib wird hauptsächlich über CYP3A4 metabolisiert und soll daher nicht gleichzeitig mit starken CYP3A4-Inhibitoren angewendet werden. Encorafenib ist sowohl ein Inhibitor als auch Induktor von CYP3A4. Die gleichzeitige Anwendung mit von CYP3A4-Substraten sollte ebenfalls mit Vorsicht erfolgen.[1]
Kontraindikation
- Überempfindlichkeit gegenüber dem Wirkstoff [1]
Zulassung
Encorafenib ist in der EU seit Ende September 2018 zugelassen und wird durch den Hersteller Pierre Fabre vermarktet.
Nutzenbewertung
Kosten
Die Kosten für die Therapie mit Binimetinib und Encorafenib belaufen sich auf rund 500 € pro Therapietag.[6]<
Quellen
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Fachinformation Fachinfo Encorafenib abgerufen am 11.11.25
- ↑ Encorafenib Eigenschaften PubChem Encorafenib abgerufen am 11.12.18
- ↑ Beschlusstext des Nutzenbewertungsverfahrens nach § 35a SGB V zum Wirkstoff Encorafenib (Neues Anwendungsgebiet: Nicht-kleinzelliges Lungenkarzinom, fortgeschritten, BRAF-V600E-Mutation, Kombination mit Binimetinib) vom 20.03.2025, BAnz AT 06.06.2025 B4
- ↑ Beschlusstext des Nutzenbewertungsverfahrens nach § 35a SGB V zum Wirkstoff Encorafenib (Melanom, BRAF-V600-Mutation, Kombination mit Binimetinib) vom 22.03.2019, BAnz AT 30.04.2019 B3
- ↑ Beschlusstext des Nutzenbewertungsverfahrens nach § 35a SGB V zum Wirkstoff Encorafenib (Neues Anwendungsgebiet: metastasiertes Kolorektalkarzinom (CRC) mit BRAF-V600E-Mutation nach systemischer Vortherapie) vom 17.12.2020; BAnz AT 22.02.2021 B1
- ↑ Therapiekosten Binimetinib Arbeitsgemeinschaft Dermatologische Onkologie abgerufen am 10.12.18