Myosin
von altgriechisch: μῦς, μυός - Maus, Muskel
Synonyme: dickes Filament, A-Filament
Englisch: myosin, thick filament
Definition
Unter Myosin versteht man eine Gruppe von Motorproteinen, die u.a. im Sarkomer der Muskelzelle vorkommen. Hier bildet Myosin zusammen mit dem Aktin, dem Tropomyosin und dem Troponin die kontraktile Einheit des Muskels. Myosine machen etwa 65 % der kontraktilen Proteine im Muskel aus.
Geschichte
Engelhardt und Lyubimova wiesen 1939 die ATPase-Aktivität von Myosin nach. H.H. Weber und Portzehl zeigten 1954 an isolierten Muskelfasern, dass die Interaktion von Aktin, Myosin und ATP die Grundlage für die Kontraktion des Muskels ist.
Einteilung
Man kann Myosine in verschiedene Klassen und Subklassen unterteilen. Zur Zeit sind mehr als 18 Klassen bekannt. Die wichtigsten Myosin-Typen sind die Klassen I, II und V. Das in der Muskelfaser vorkommende Myosin ist in Klasse II eingestuft und wird auch als "konventionelles" Myosin bezeichnet. Die anderen Myosine werden als "unkonventionelle" Myosine (auch: Minimyosine) zusammengefasst und sind u.a. für den intrazellulären Transport von Vesikeln verantwortlich. Im menschlichen Genom wurden bis jetzt 39 Gene gefunden, die für die Bildung der verschiedenen Myosinarten zuständig sind.
| Klasse | Gennamen | Funktion |
|---|---|---|
| II | MYH1, MYH2, MYH3, MYH6, MYH7, MYH9, MYH10, MYH11 usw. | Muskelkontraktion (skelettal, kardial, glatt); nicht‑muskuläre Isoformen regulieren Zellmigration, Adhäsion, Zytokinese |
| I | MYO1A–MYO1H | Einzelkopf‑Motoren; beteiligt an amöboider Zellbewegung, Phagozytose, Membran‑Ruffling |
| III | MYO3A, MYO3B | Einzelköpfig; Rolle z. B. in Phototransduktion |
| V | MYO5A, MYO5B, MYO5C | Transport von Vesikeln/Cargo entlang Aktin |
| VI | MYO6 | Unkonventioneller Rückwärts‑Motor (Bewegung zum Minus‑Ende von Aktin); Transport, Endozytose |
| VII | MYO7A, MYO7B | MyTH4‑FERM‑Motiv; z.B. in Stereocilien |
| X | MYO10 | MyTH4‑FERM‑Motor bei Filopodien; Zellmigration, Signalvermittlung |
| IX, XV, XVI, XVIII, XIX | MYO9A/B, MYO15A, MPEG, MYO18A, MYO19 | Verschieden, z.B. Zytoskelett‑Organisation, Filopodienstabilität, neuronal |
Die weiteren Angaben beziehen sich auf das konventionelle Myosin.
Aufbau
Grobstruktur
Die Myosinfilamente des Skelettmuskels (auch "dicke Filamente" genannt) bestehen aus ca. 200 Myosin-II-Molekülen mit einem Molekulargewicht von je rund 500 kDa. Das Myosinmolekül lässt sich grob in drei Abschnitte unterteilen:
- Kopfteil ("Myosinköpfchen")
- Halsteil
- Schwanzteil
Der Kopfteil sorgt für die Bindung an das Aktin. Der Halsteil dient als bewegliches Scharnier. Mit Hilfe des langen Schwanzteils können sich mehrere Myosinmoleküle zu Bündeln (Filamenten) zusammenlagern.
Feinstruktur
Das Myosin-II-Molekül liegt als so genanntes Dimer vor und besteht aus 6 Unterheiten (Hexamer):
- Schwere Ketten ("Heavy Chains", "HC"): Die 2 schweren Ketten bestehen jeweils aus einer sehr langen Polypeptidkette und einer kurzen, prominenten globulären Domäne. Ihr Molekulargewicht beträgt jeweils etwa 230 kDa. Die schnurartige Polypeptidkette hat einen Durchmesser von 2 nm. Das C-terminalen Ende (Molekularmasse C-Terminus: 20 kDa) des Moleküls setzt sich aus mehr als 1.300 Aminosäuren zusammen, die eine verdrillte α-Helix-Struktur bilden ("coiled-coil"). Ihre Aminosäuresequenz zeichnet sich durch die Wiederholung eines kurzen Sequenzmotivs, des so genannten "Heptad-Repeat" aus. An der ersten und vierten Position des Repeats befinden sich in der Regel hydrophobe Aminosäuren. Die kurze, globuläre Domäne am N-terminalen Ende (Molekularmasse N-Terminus: 20 kDa) des Moleküls besteht aus ca. 800 Aminosäuren und wird auch als "Motordomäne" bezeichnet, da sie eine starke Affinität für Aktin aufweist und ATP hydrolysiert (Dualfunktion).
- Leichte Ketten ("Light Chains", "LC"): Die 4 leichten Ketten sind relativ kleine Proteine, die ein Molekulargewicht zwischen 16 und 24 kDa besitzen. Sie sind mit dem Kopf- bzw. Halsteil der schweren Ketten assoziiert. Die Köpfchen-nahe Light Chain wird auch als essentielle Kette und die Köpfchen-fernere als regulatorische Kette bezeichnet. Nach ihrer Extraktionsmethode kann man die leichten Ketten weiter in "alkaline light chains" (LC1 und LC3) und "DTNB light chains" (LC2) unterteilen. Die leichten Ketten besitzen eine hohe Affinität für Calcium und regulieren wahrscheinlich die Beweglichkeit des Halsteils.
Zwei schwere Ketten bilden zusammen ein Myosin-Dimer. Im Schwanzteil des Myosin-Dimers verdrillen sich die schnurartigen Polypeptidketten der beiden Monomere zu einer Superhelix, wobei die ihr zugrunde liegenden Helices parallel oder antiparallel angeordnet sein können.
Aus den Myosinmolekülen lassen sich auch durch reversible Depolymerisierung wieder Monomere bilden (dann Myosin Typ I). Hierzu wird eine Salzlösung mit hoher Ionenstärke benötigt, z.B. über 300 mmol 0,1-molares KCl, oder stark denaturierende Lösungen wie 5-molare Guanidin-HCl oder 8-molarer Harnstoff.
Am Übergang zum Halsbereich, an den leichten Ketten, befindet sich ein Calmodulin-Molekül (Molekularmasse pro Calmodulin: 17 kDa). Es dient als Sensor für Calcium. Steigt der Calcium-Spiegel auf über 500 nM, wird Calmodulin durch Bindung von 3 oder 4 Ca2+ aktiviert, was wiederum die Myosinleichtkettenkinase (MLCK) aktiviert. Es resultiert die Phosphorylierung der leichten Ketten.
Fragmente
Myosin kann durch bestimmte Proteasen, wie Papain und Trypsin in Fragmente gespalten werden. Es wird vermutet, dass an den Angriffsstellen der Proteasen die Superhelix-Struktur unterbrochen ist und hier die molekularen Scharniere ("hinge points") zwischen Kopf- und Schwanzteil liegen.
...nach Spaltung durch Trypsin
Trypsin spaltet Myosin in 2 Fragmente:
- Schweres Meromyosin (heavy meromyosin, HMM): Es enthält den Kopfteil, sowie ein kurzes Stück der Superhelix ("Halsteil") und besitzt eine Molekularmasse von etwa 350 kDa.
- Leichtes Meromyosin (light meromyosin, LMM): Es enthält den Rest der Superhelix und damit das größere Stück des Schwanzteils und besitzt eine Molekularmasse von ungefähr 150 kDa (2).
...nach Spaltung durch Papain
Unmittelbar am Kopf befindet sich eine zweite "Sollbruchstelle", an der das schwere Meromyosin durch Papain gespalten werden kann. Dadurch entstehen weitere Fragmente:
- Subfragment 1 (S1, SF1): Es hat ein Molekulargewicht von etwa 110 kDa und entspricht den isolierten Motordomänen.
- Subfragment 2 (S2, SF2): Dieser Teil stellt den Abschnitt der Superhelix dar, der zwischen den Spaltpositionen des Trypsins und Papains liegt. Als hydrophiler "Halsteil" sorgt er für die segmentale Flexibilität.
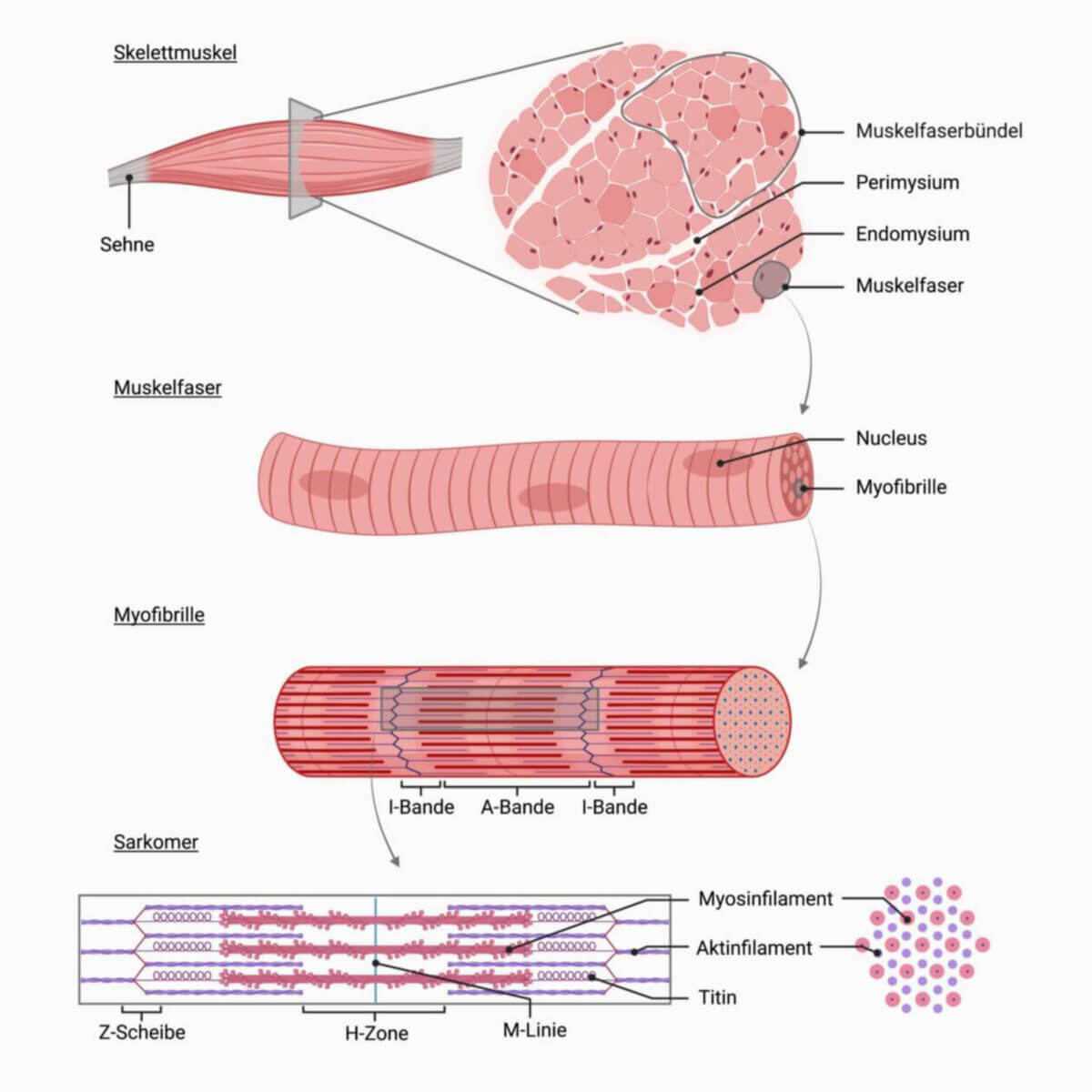
Integration in das Sarkomer
Das Myosin ist durch das Strukturprotein Titin (Molekularmasse pro Titin: 3 Mio. Dalton) elastisch mit den Z-Scheiben des Sarkomers verbunden. Dabei fixieren je 6 Titinfilamente ein Myosinfilament.
Zudem ist β-Aktinin (Molekularmasse pro β-Aktinin: 37 kDa) um das Myosinfilament gewoben. In einem Sarkomer befinden sich ca. 1.000 Myosinfilamente, assoziiert zu einem Polymer, die von ca. 2.000 Aktinfilamenten umgeben sind. In der Mitte des Sarkomers, wo die Myosinmoleküle miteinander vernetzt sind, befindet sich die M-Zone. In ihr sind Myomesine (Molekularmasse pro Myomesin: 190 kDa), die die dicken Filamente miteinander verbinden, und myosinbindende C-Proteine (Molekularmasse pro C-Protein: 150 kDa), die zudem eine Bindung an Titin vermittlen, eingelagert.
Ein Myosinfilament bildet nach den Seiten ca. 100 Querbrücken aus. Je nach Myosinmolekül-Struktur und Myoglobingehalt lassen sich mehrere Formen von Muskelfasern unterscheiden. Hierzu trägt auch die Aktivität der ATPase bei.
Des Weiteren existieren α-Myosin und β-Myosin. Ersteres findet sich ausschließlich im Herzen.
| Struktur | Dimensionen |
|---|---|
| Myosinfilament | Länge: 1,6 µm Durchmesser: 15 nm |
| Myosin-Monomer | Länge: ca. 160 nm Durchmesser: 20-40 nm |
| S1-Fragment | Länge: ca. 17 nm |
| S2-Fragment | Länge: ca. 26 nm |
| Myosinköpfchen | Länge: 16,5 nm Breite: 6,5 nm Tiefe: 4 nm |
| Abstand Aktin - Myosin | ca. 23 nm |
| Abstand benachbarter Myosinköpfchen | dexter-sinister: ca. 14 nm anterior-posterior: ca. 43 nm |
Mikroskopische Struktur
Gemeinsam mit den Aktinfilamenten begründen die Myosinfilamente die mikroskopische sichtbare Querstreifung der Skelettmuskulatur. Bereiche, die nur Aktinfilamente beinhalten, sind isotrop (einfach lichtbrechend) und erscheinen als I-Streifen. Die myosinhaltigen Abschnitte (bare zone) sind doppelt lichtbrechend bzw. anisotrop und erscheinen als A-Abschnitt bzw. A-Bande, welches 300 nm lang ist. Aufgrund der medianen Verdickung der Myosinfilamente kommt die M-Zone (auch: M-Streifen) zustande, die von zwei helleren H-Streifen flankiert wird. Die M-Zone enthält strukturgebende Proteine wie Myomesin, welche die Myosinfilamente zentral verankern und deren Ausrichtung stabilisieren.
Funktionen
Das Myosinköpfchen ist sowohl für die Bindungsstelle zum Aktinfilament, als auch für die Hydrolyse von Adenosintriphosphat (ATP) im S1-Fragment des Moleküls verantwortlich. Die ATP-Bindungsstelle ist ca. 4 nm von der aktinbindenden Stelle entfernt.
Querbrücken-Zyklus
Bei der Muskelkontraktion spielt das Myosinfilament eine entscheidende Rolle. Anhand des Querbrücken-Zykluses lassen sich die verschiedenen Vorgänge beim Hineingleiten der Aktinfäden in die Myosinzwischenräume bei der Querbrückenbildung erkennen. (Gleitfilamenttheorie nach Huxley):
- Zunächst ist das Aktinfilament mit dem Myosinköpfchen fest verbunden.
- Dann wird ATP gespalten, die Myosinköpfchen verspannen sich.
- Mit dem Anstieg von Ca2+ kommt es zur Querbrückenbildung durch Anheften des Myosinkopfes an ein benachbartes Aktin-Molekül (Pre-Power-Stroke Konformation)
- Die Verspannung wird in mechanische Energie umgesetzt, vergleichbar mit einem Ruderschlag. Der Myosinkopf kippt von 90° auf ca. 40–50° um (Post-Power-Stroke Konformation).
Der beschriebene Zyklus dauert etwa 10–100 ms. Je nach vorhandener ATP-Menge, kann der Vorgang dann erneut beginnen. Bei der Muskelkontraktion verkürzt sich die Länge des Sarkomers, jedoch nie die Länge des Myosinfilamentes oder des Aktinfilamentes. Die Zugkraft eines einzigen Myosin-Moleküls beträgt etwa 3–6 pN.
ATP-Spaltung
Im Myosinköpfchen bzw. in dessen S1-Segment vollzieht sich unter anderem die Hydrolyse von ATP, welche reversibel ist. Die ATP-bindende Domäne von Myosin hat folgende Sequenz:
- Glu-Glu-Ser-Gly-Ala-Gly-Lys-Thr
Die Hydrolyse wird durch das Enzym ATPase beschleunigt. Es spaltet das ATP mit einer Geschwindigkeit von ungefähr 0,02–8 Molekülen pro Sekunde in Adenosindiphosphat (ADP) und einen PO4-Rest. Die ATPase-Aktivität wird durch K+, Ca2+, Mg2+ und NH4+ aktiviert. In Assoziation mit Aktin hydrolysiert das Myosinmolekül zusammen mit der ATPase 5–10 ATP-Moleküle pro Sekunde. Die isolierte Myosin-ATPase bräuchte ca. 30 min für die Spaltung von ATP. Die Assoziation von Aktin und Myosin bezeichnet man auch als Actomyosin oder "rigor state".
Der reine ATP-Vorrat im Muskel reicht für etwa 3 Sekunden. Es stehen jedoch verschiedene Synthese-Möglichkeiten von ATP zur Verfügung, beispielsweise durch ADP, Kreatinphosphat, Glucose und Fett.
Weitere Funktionen
Neuste Untersuchungen belegen, dass das Myosin - zusammen mit Aktin - auch im Zellkern (Nucleus) Funktionen ausübt. Hier sind die beiden Muskelproteine u.a. für die Transkription, d.h. dem Ablesen genetischer Informationen verantwortlich.
Pathophysiologie
Durch Mutationen bedingte Strukturveränderungen des β-Myosins können die Ursache von Muskelerkrankungen sein. Ein Beispiel dafür ist die so genannte hypertrophe Kardiomyopathie (HCM).
Trivia
Myosin oder Myosin-ähnliche Verbindungen existieren auch in Pflanzen. So sind die Protoplasma-Strömungen in den Internodialzellen und die Bewegung von Chloroplasten (Mougeotia, Vallisneria) abhängig von Mikrofilamenten.