Gastrointestinaler Stromatumor
Synonyme: GIST
Englisch: Gastro-Intestinal-Stromal-Tumor
Definition
Gastrointestinale Stromatumoren, kurz GIST, sind die häufigsten mesenchymalen Tumoren (Sarkome) des Gastrointestinaltraktes, die erst seit 1998 eindeutig diagnostiziert werden können. In den meisten Fällen treten GIST sporadisch auf.
Hintergrund
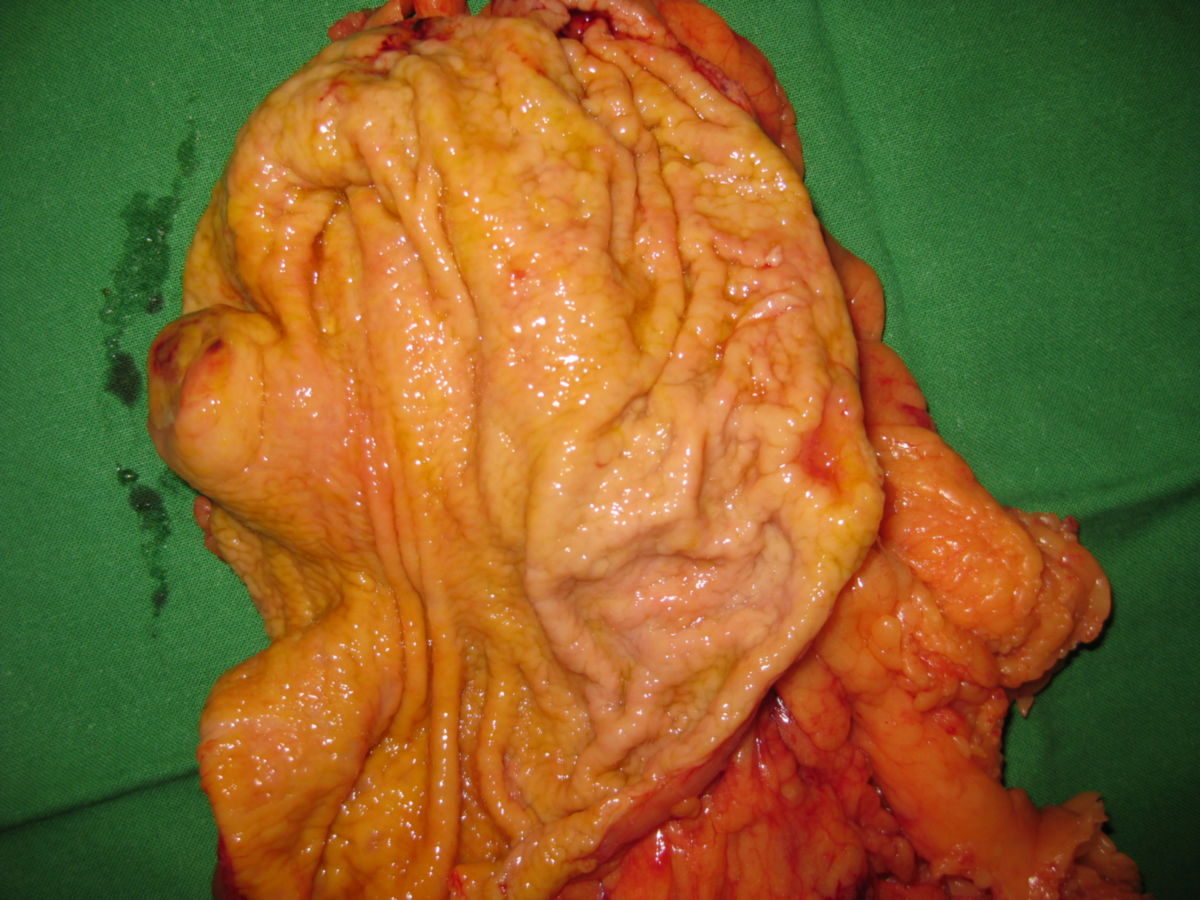
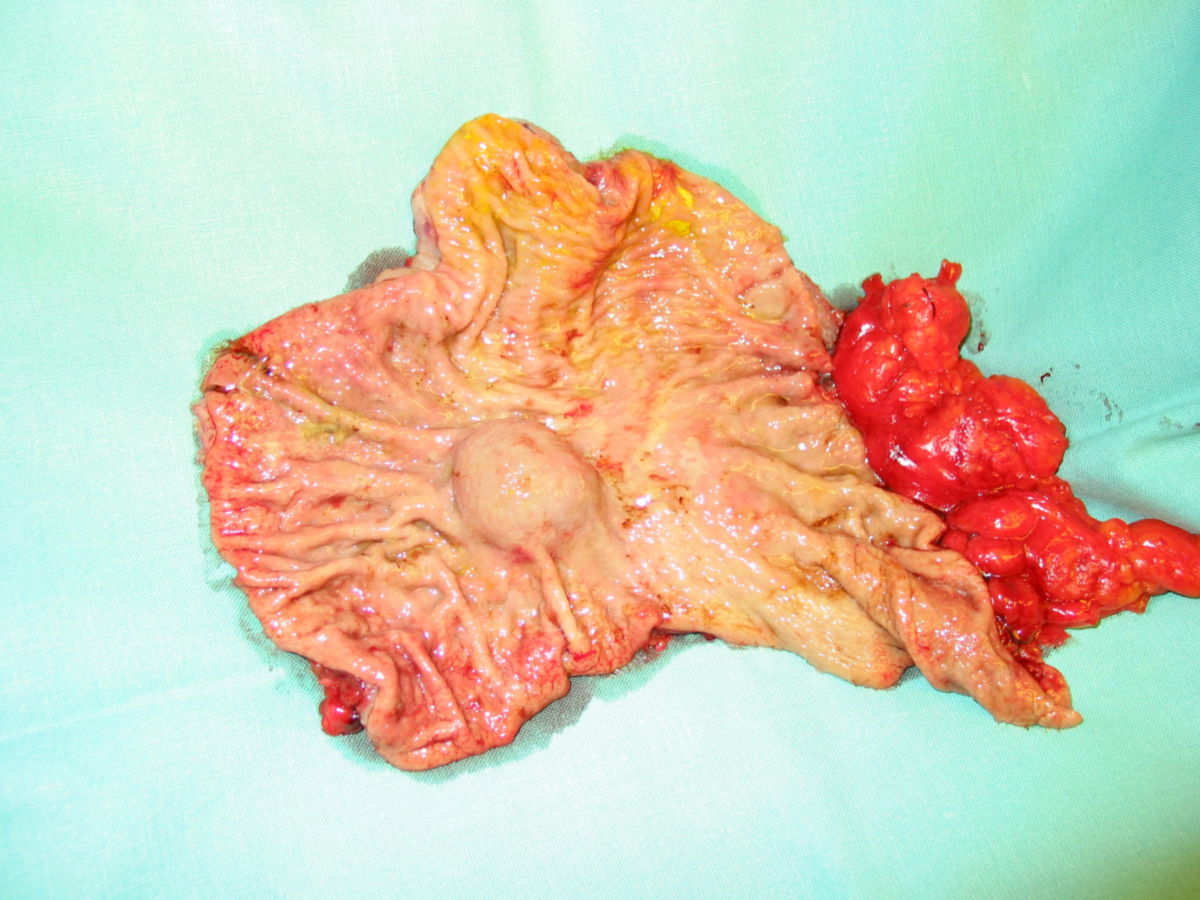
Die Entdeckung, dass man GIST anhand des so genannten KIT-Proteins nachweisen kann (Hirota 1998), half festzustellen, dass sich GIST aus den so genannten "Cajal-Zellen" oder gemeinsamen Vorstufen entwickeln. Dies sind "Schrittmacher-Zellen", die in der äußeren Wand des Verdauungstraktes angeordnet sind. GIST entstehen also in der Wand der Verdauungsorgane. Sie wachsen von dort meistens nicht in die Organe hinein, sondern breiten sich ungehindert in den Bauchraum aus. Daher werden sie oft auch erst sehr spät und in einer teilweise enormen Größe diagnostiziert.
Etwa die Hälfte der Patienten mit neu diagnostiziertem GIST weisen bereits Metastasen auf. GIST-Metastasen findet man am häufigsten in der Leber (ca. 65 %) oder im Peritoneum (ca. 20 %) – sehr selten in anderen Organen. Grundsätzlich sollte das Wort "benigne" in Verbindung mit GIST nicht gebraucht werden, da alle GIST potenziell maligne sind, d.h. alle GIST – auch kleine Tumoren – durchaus zu Streuherden führen können.
Epidemiologie
Das mediane Alter bei Erkrankungsbeginn liegt zwischen 55 und 65 Jahren. Allerdings gibt es auch vereinzelt Patienten im Kindes- und Jugendalter (Pädiatrische GIST). Experten schätzen die Inzidenz auf ca. 15 Neuerkrankungen je 1 Mio., also ca. 1.200 neue Fälle p.a. in Deutschland.
Pathogenese
Der Entstehungsgrund für GIST ist bisher nicht geklärt. Entscheidend für die Pathogenese scheint eine Mutation im KIT- oder PDGF-Rezeptor alpha zu sein, die zu einer kontinuierlichen ligandenunabhängigen Aktivität der Rezeptor-Tyrosinkinase führt. Am häufigsten betroffen sind KIT Exon 11 (ca. 70%), KIT Exon 9 (ca. 10%) und PDGFR alpha Exon 18 (ca. 6%). In etwa 10 % der Fälle ist keine Mutation im KIT- oder PDGFRA-Gen nachweisbar (= Wild Typ). Die Ermittlung des Mutationsstatus im Rahmen der Diagnostik ist wichtig, da die Mutation auf das Therapieansprechen und die Prognose einen entscheidenden Einfluss hat.
Aufgrund der therapeutischen Konsequenzen sollte eine Mutationsanalyse von einem erfahrenen Pathologen durchgeführt werden.
Lokalisation
Die wesentlichen Lokalisationen sind
- 50 - 60 % im Magen
- 20 - 30 % im Dünndarm
- 2 - 5 % in der Speiseröhre
- 5 - 12 % im Dickdarm und Rektum
Symptome
Die ersten Anzeichen bei Patienten mit GIST hängen von der Tumorgröße und der Lokalisation des Primärtumors ab. Ein signifikanter Anteil kleiner und asymptomatischer Tumoren wird zufällig bei diagnostischen Maßnahmen (Endoskopie) oder im Rahmen anderer operativer Eingriffe entdeckt. Ein relevanter Anteil wird im Rahmen einer Notfalloperation aufgrund von gastrointestinaler Obstruktion oder Tumorperforation mit abdomineller Blutung diagnostiziert.
Die häufigsten Symptome:
- Tumoren Magen oder Duodenum
- Schmerzen 50 – 70 %
- Gastrointestinale Blutungen 20 – 50 %
- Völlegefühl
- Dünndarm-Tumoren
- Schmerzen
- Blutung
- Obstruktion
- Dickdarm-Tumoren
- Blutauflagerung Stuhl
- Obstruktion
- Ösophagus
- Unspezifische Allgemeinsymptome
Diagnostik
Zwei Hauptkriterien entscheiden in den meisten Fällen, ob ein Weichgewebstumor als GIST erkannt wird:
- Die Lokalisation des Tumors
- Das fehlerhafte (mutierte) Gen („positive c-KIT“ (CD117))
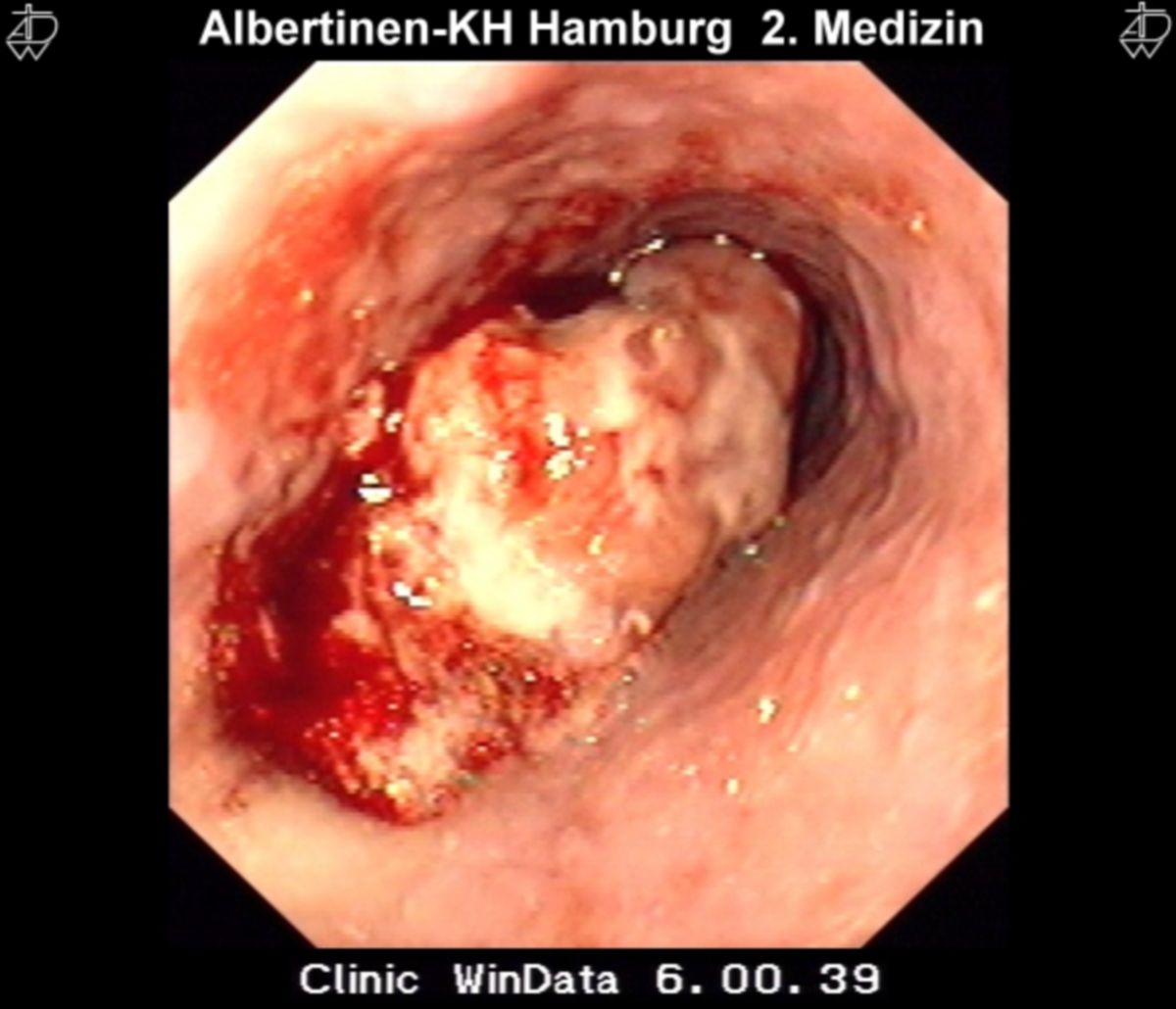
Die bildgebende Diagnostik dient der Erfassung des Primärtumors und evtl. vorhandener Metastasen. Je nach Lokalisation des Primärtumors kommen Endosonografie und endoskopische Verfahren mit Gewinnung von Biopsien zum Einsatz. Zusätzlich sind Schnittbildverfahren zur Beurteilung der lokalen Tumorausdehnung und zur Erfassung von peritonealen Metastasen oder Fernmetastasen notwendig. Um das „defekte“ Gen eindeutig nachzuweisen, sind die modernen Methoden der Pathologie (Histologie, Immunhistochemie, Molekulargenetik, Mutationsanalyse, etc.) essentiell.
Im Wesentlichen unterscheidet man die folgenden Diagnosen – Erkrankungsstadien:
- Lokal begrenzter, operabler Primärtumor (keine Metastasierung)
- Zunächst nicht oder nur äußerst schwer operabler Primärtumor (keine Metastasierung)
- Inoperabler / metastasierter (fortgeschrittener) GIST mit einzelnen Fernmetastasen oder umfangreicher Metastasierung
- Progression (Fortschreiten der metastasierten Erkrankung unter medikamentöser Therapie) – als lokalisierter oder systemischer Progress
Diagnostik, Therapie und Verlaufskontrolle der GIST erfordern eine enge interdisziplinäre Zusammenarbeit unterschiedlicher medizinischer Fachrichtungen. Aufgrund der Seltenheit der Erkrankung und aufgrund der Tatsache, dass vor allem für die fortgeschrittene Erkrankung viel Expertise und Erfahrung notwendig sind, ist die Behandlung in einem erfahrenden GIST-/Sarkomzentrum angezeigt. Dies kann für den Erkrankungsverlauf und die Prognose des Patienten von großer Bedeutung sein.
Therapieoptionen
Bei lokal begrenztem, operablem Primärtumor
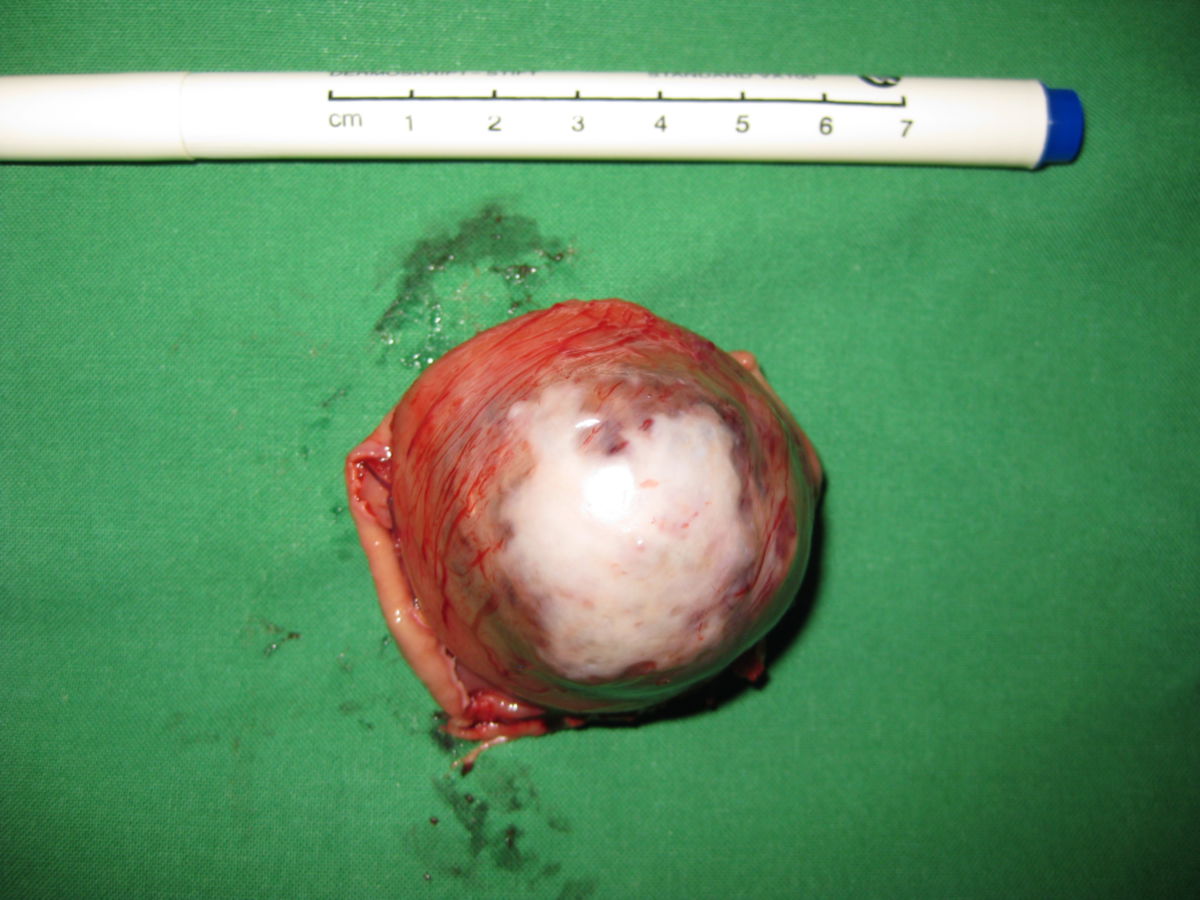
Operation: Die R0-Resektion ist bislang noch immer das beste prognostische Kriterium. Lokal begrenzte, operable Tumoren sollten daher immer chirurgisch entfernt werden, wenn eine komplette Entfernung auf Grund der Befunde möglich ist. Erfahrungsgemäß haben jedoch mindestens 50% aller Patienten nach einer kompletten Resektion ein Rezidiv oder bekommen Metastasen. Die 5-Jahres-Überlebensrate liegt bei etwa 50%. Daher sind – je nach Rezidiv-Risiko – eine adjuvante Therapie und/oder die Langzeitüberwachung der Patienten – in kurzen Zeitabständen – extrem wichtig, selbst nach erfolgreicher Entfernung des Tumors. Die derzeit verwendete Methode zur Ermittlung der Rückfall-Wahrscheinlichkeit (Rezidiv-Risiko) ist die Miettinen-Tabelle (2006). Diese Risikoeinteilung beruht auf einer Untersuchung von ca. 2.000 GIST-Fällen und bezieht neben Tumorgröße und Mitoserate auch die Tumorlokalisation mit ein.
Tyrosinkinasehemmer: Um das Rezidivrisiko zu reduzieren, ist seit Mai 2009 in Europa die adjuvante Therapie mit dem oral verfügbaren Tyrosinkinaseinhibitor Imatinib zugelassen. Die adjuvante Therapie (Standarddosierung 400 mg/d) zielt darauf ab, möglicherweise vorhandene, nicht sichtbare Tumorzellen oder Mikrometastasen zu behandeln und damit die Wahrscheinlichkeit eines Rezidives zu senken.
Entscheidungsgrundlage für eine Imatinib-Therapie:
- Für jeden Patienten mit einem lokal begrenzten, operablen Primärtumor muss die Risikoklasse ermittelt werden. Diese Risikoklassifizierung erfolgt nach der Miettinen-Tabelle (2006).
- Immer wichtiger bei der Entscheidung, ob ein Patient eine adjuvante Imatinib-Therapie erhält ist das Wissen um die Primär-Mutation (Exon-Bestimmung = Mutationsanalyse).
In einer Art „Ampel-Modell“ wird die adjuvante Imatinib-Therapie wie folgt eingesetzt:
ROT Niedrigrisiko-Patienten: werden nicht behandelt
GELB Mittelrisiko-Patienten: können behandelt werden
GRÜN Hochrisiko-Patienten: werden behandelt
Die derzeit – auf Studien basierende – maximale adjuvante Behandlungsdauer mit Imatinib beträgt 3 Jahre bei signifikanten Rezidiv-Risiko. Die Ruptur eines lokal primäreren Tumors z. B. während einer Operation wird wie ein metastasierter GIST eingestuft, da das Metastasierungsrisiko nach einer Tumorruptur nahezu 100% beträgt. Eine sofortige Dauertherapie mit Imatinib ist hier angezeigt.
GIST-Patienten sollten nach erfolgreicher Operation nicht als „geheilt“ entlassen werden. Hier ist die nachfolgende Weiterbehandlung ggf. mit einer adjuvanten Imatinib-Therapie bzw. die langjährige Verlaufskontrolle durch einen mit GIST erfahrenen Onkologen angezeigt.
Bei zunächst nicht oder äußerst schwer operablem Primärtumor
Sollten Primärtumore zunächst nicht oder nur äußerst schwer operabel sein, setzen mit GIST erfahrene Mediziner Imatinib neoadjuvant ein. Das Ziel einer neoadjuvanten Imatinib-Therapie ist es, eine verbesserte Ausgangssituation für die Operation zu erreichen. Das heißt: Den Tumor operabel zu machen oder die Ausmaße der Operation unter Umständen zu verringern.
Bei inoperablem/metastasiertem (fortgeschrittenem) GIST
Konventionelle zytotoxische Chemotherapien mit Substanzen wie z. B. Doxorubicin oder Ifosfamid, welche bei anderen fortgeschrittenen Sarkom-Subtypen eingesetzt werden, haben bei der Behandlung der GIST keinerlei Stellenwert.
Tyrosinkinasehemmer: Mit Imatinib und anderen Tyrosinkinasehemmern (TKIs) können gute Ergebnisse bei der Behandlung von metastasierten und inoperablen GIST erzielt werden. Mit 400 mg/d Imatinib steht eine systemische Basistherapie in der Erstlinientherapie zur Verfügung, die aufgrund guter Wirksamkeit (Ansprechraten von 70 - 90%) und der guten Verträglichkeit einen Gewinn an Lebenszeit mit sich bringt. Das Gesamtüberleben wurde – im Median – von weniger als 1 Jahr auf ca. 5 Jahre verlängert. Es gibt Patienten mit metastasiertem GIST, die über einen langen Zeitraum von der Imatinib-Therapie profitieren. Nach zweifelsfreier Diagnosestellung eines inoperablen Tumors und/oder bei Nachweis von Metastasen sollte eine Imatinib-Therapie unmittelbar begonnen werden. Wichtig ist auch die Ermittlung des Mutationsstatus, da dieser therapierelevant ist. Patienten mit Exon-11-Mutationen sprechen gut auf die medikamentöse Therapie mit Imatinib an, Exon-9-Patienten müssen mit höheren Dosen (800 mg/d) behandelt werden. GIST-Patienten mit der speziellen Primärmutation Exon-18-D842V sprechen nicht auf Imatinib an.
Kontrollierte Studienabbrüche nach 3- und 5-jähriger Imatinib-Therapie zeigten bei den Patienten in kürzester Zeit Krankheitsprogression. Daher sollte eine Imatinib-Therapie bei fortgeschrittener (metastasierter) Erkrankung in voller Dosierung bis zum zweifelsfreien Nachweis eines Progresses nicht abgesetzt werden.
Metastasen-Chirurgie: Der Stellenwert der Metastasen-Chirurgie bei metastasierter - fortgeschrittener Erkrankung unter medikamentöser Therapie ist in Studien bisher ungeklärt. Man kann derzeit nur aus Praxis-Erfahrungen vermuten, dass Patienten unter medikamentöser Therapie, die zusätzlich chirurgisch behandelt werden (Entfernung der medikamentös kontrollierten Läsionen) von diesen Eingriffen profitieren.
Bei Progression (der metastasierten Erkrankung unter medikamentöser Therapie)
Trotz der Wirksamkeit von Imatinib bei GIST, sind Progressionen bereits nach zwei bis drei Jahren zu beobachten. Die erste Maßnahme bei Verdacht auf eine Progression der Erkrankung ist die genaue Verifizierung:
Zentrale Fragen sind hierzu u. a.:
- Wie steht es um die Compliance des Patienten?
- Nimmt der Patient komplementäre Therapien ein, welche ggf. die Wirkung der Target-Therapie beeinflussen?
- Ist überhaupt eine Progression im klaren Sinne bestätigt? (Ansprechen in der Bildgebung)
- Stimmt die histologische Diagnose GIST überhaupt? (Ursprungsdiagnose)
Therapie-Ansprechen der Target-Therapien bei GIST sollte nicht nur auf der „Größenreduktion“ von Läsionen basieren (RECIST-Kriterien). Bei GIST gelten die „CHOI-Kriterien“ zur radiologischen Beurteilung. Diese beruhen auf der Messung im CT der Tumordichte in Hounsfield-Units (HU), da auch bei unveränderter Tumorgröße aber gleichzeitiger Abnahme der Tumordichte von einem Therapie-Ansprechen ausgegangen wird. Leider kommt es in der Praxis immer wieder zu Fehlinterpretationen durch Radiologen, die unveränderte Läsionen oder sogar leichte Größenzunahmen als Progress und somit Therapie-Versagen deuten.
Dosis-Eskalation: Falls der Progress unter Imatinib-Therapie bestätigt ist, ist als erste Maßnahme die Dosiserhöhung auf 800mg/d angezeigt.
Zweitlinientherapie: Patienten mit metastasierten GIST, die eine Imatinibresistenz bzw. -unverträglichkeit aufweisen, können als Zweitlinientherapie mit den Tyrosinkinaseinhibitoren Sunitinib oder Regorafenib behandelt werden. Sunitinib wird – gemäß Zulassung – im Sechs-Wochen-Zyklus (Vier Wochen Therapie, gefolgt von zwei Wochen Pause) in einer Dosierung von 50 mg/d gegeben. Doch inzwischen setzt sich in der klinischen Praxis alternativ eine Dauertherapie (ohne Pausen) mit 37,5mg/d immer mehr durch.
Sonstige Optionen:
- Systemische Therapien: Ggfls. in klinischen Studien verfügbar
- In Ergänzung zu medikamentösen Optionen: Lokal wirksame Verfahren (z. B. Resektion, RFA, SIRT etc.) zur Entfernung einzelner progredienter Läsionen
Therapie- und Nebenwirkungsmanagement
Ein wichtiger Teil des Therapie-Konzeptes der GIST, sind die medikamentösen (oralen) Target-Therapien. Damit diese modernen, zielgerichteten Therapien möglicht lange wirken können, ist unter anderem die Compliance entscheidend. Doch dies beinhaltet nicht nur die tägliche Einnahme der Tabletten oder Kapseln. Compliance - bei den oralen Target-Therapien - erfordert eine umfassende Aufklärung des Patienten und ein professionelles Therapie- und Nebenwirkungsmanagement durch das Behandlungsteam.
Nachsorge/Verlaufskontrolle
Da Rezidive in etwa 40 % der Fälle in den ersten zwei Jahren auftreten, ist eine engmaschige Patientenüberwachung bei GIST und bei den Target-Therapien unerlässlich. Eine gute Verlaufs-kontrolle erfolgt interdisziplinär. Die Nachsorge-Intervalle – alle 3 bis 6 Monate – richten sich nach den Risikogruppen, die Untersuchungsmethoden nach der Lokalisation des Primärtumors und der Metastasierung.