MTOR-Komplex 1
Definition
Der mTOR-Komplex 1, kurz mTORC1, ist einer der beiden Proteinkomplexe, die als zentralen Bestandteil die Serin/Threonin-Proteinkinase mTOR enthalten. mTORC1 integriert eine Vielzahl extra- und intrazellulärer Reize und reguliert entsprechend die Balance zwischen Anabolismus und Katabolismus in der Zelle.
siehe auch: mTOR-Komplex 2
Aufbau
Proteine
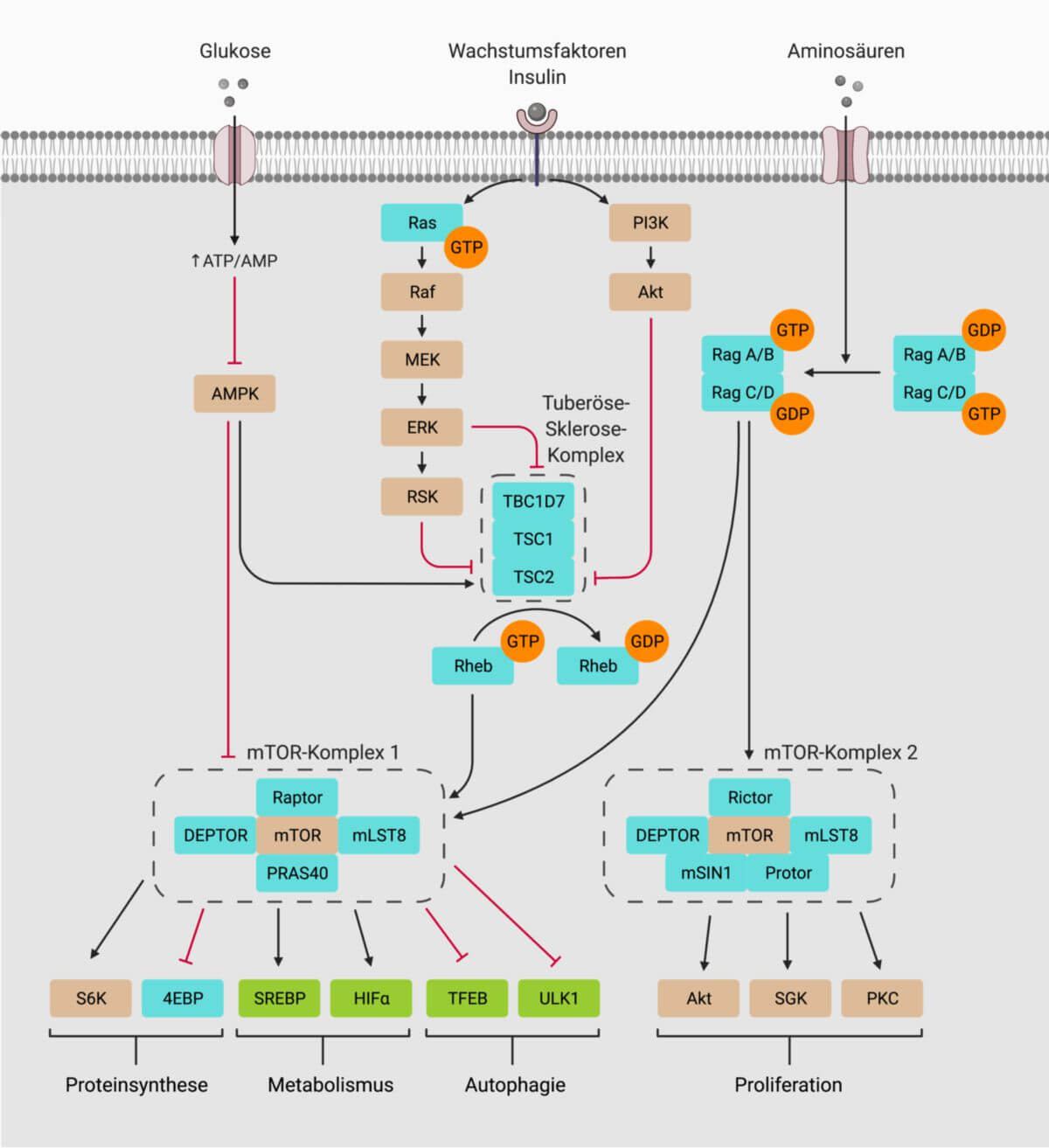
mTORC1 besteht aus fünf Untereinheiten:
- mTOR (mechanistic target of rapamycin): zentraler Bestandteil mit Kinase-Aktivität
- Raptor (regulatory protein associated with mTOR): unterstützt die Substratbindung und reguliert die subzelluläre Lokalisation
- mLST8 (mammalian lethal with Sec13 protein 8): bindet an die katalytische Domäne
- PRAS40 (proline-rich Akt substrate of 40 kDa): inhibitorische Untereinheit
- DEPTOR (DEP domain containing mTOR interacting protein): inhibitorische Untereinheit
Struktur
Der Komplex bildet ein obligates Dimer mit einem Molekulargewicht von 1 MDa und den Dimensionen 290 x 210 x 135 Å. Er hat eine rhomboide Form mit einem zentralen Hohlraum. Jedes Dimer besteht wiederum aus zwei Heterotetrameren. Die Dimerisierung basiert auf einer Interaktion zwischen den zwei mTOR- und den zwei Raptor-Untereinheiten. Die mLST8-Untereinheiten ragen als distale, fußähnliche Ausstülpung heraus. PRAS40 ist mittig, in der Nähe zu Raptor, lokalisiert.
Die DEPTOR-Untereinheit ist in den existierenden Kristallstrukturen nicht enthalten.
Regulation
Aktivierende Faktoren
Folgende Faktoren wirken aktivierend auf mTORC1:
An der Aktivierung sind verschiedene zelluläre Sensoren und Signalwege beteiligt, nachfolgend ist dies für Aminosäuren und Wachstumsfaktoren detaillierter erläutert.
Aminosäuren
Die Aktivierung durch Aminosäuren wird durch die heterodimeren Rag-GTPasen vermittelt. Es existieren vier verschiedene solcher GTPasen, Rag A und Rag B können dabei jeweils Heterodimere mit Rag C oder Rag D bilden. Sie binden durch ihre Interaktion mit dem Ragulator-Komplex an die Membran des Lysosoms. Aminosäuren stimulieren die Umwandlung der Rags in ihren aktiven Zustand. Dadurch sind sie in der Lage, Raptor zu binden und mTORC1 zum Lysosom zu rekrutieren. Hier kann mTORC1 durch Rheb aktiviert werden.
Es existieren separate zelluläre Mechanismen um intralysosomale und zytosolische Aminosäuren zu detektieren. Aminosäuren innerhalb des Lysosoms aktivieren Rags durch einen Mechanismus an dem die lysosomale v-ATPase und der Aminosäuretransporter SLC38A9 beteiligt sind. Zytosolisches Leucin und Arginin binden an ihre Sensoren Sestrin 2 bzw. CASTOR1, die wiederum über die GATOR1- und GATOR2-Komplexe die Rag-Aktivität modulieren.
Wachstumsfaktoren
Signalwege, die durch Wachstumsfaktoren aktiviert werden (z.B. der Insulin/IGF-1-Signalweg und der Ras/Raf/MAPK-Signalweg) werden alle durch den Tuberöse-Sklerose-Komplex integriert. Dieser besteht aus Hamartin (TSC1), Tuberin (TSC2) sowie TBC1D7 und fungiert als GTPase-aktivierendes Protein für die GTPase Rheb, einen essentiellen Aktivator von mTORC1. Im Insulin-IGF1-Signalweg wird die Serin/Threonin Kinase Akt aktiviert, die TSC2 phosphoryliert und somit inhibiert. Rezeptortyrosinkinasen aktivieren mTORC1 im Zuge des Ras/Raf/MAPK-Signalwegs, der die ERK- und p90RSK-abhängige Phosphorylierung von TSC2 auslöst.
Inhibierende Faktoren
Verschiedene Formen von zellulärem Stress wirken inhibierend auf die mTORC1-Aktivität. Hierzu zählen:
Die AMP-abhängige Kinase (AMPK) spielt bei diesen Vorgängen eine wichtige Rolle. Sie wird durch zellulären Energiemangel aktiviert und inhibiert mTORC1 sowohl indirekt, über die Aktivierung von TSC2, als auch direkt, durch die Phosphorylierung von Raptor. DNA-Schäden induzieren die p53-abhängige Expression von AMPKβ, PTEN und TSC2, die nachfolgend mTORC1 hemmen.
Substrate
mTOR reguliert direkt oder indirekt die Phosphorylierung von mehr als 800 Proteinen. Nachfolgend sind einige der wichtigsten Substrate von mTORC1 aufgelistet, eingeteilt nach ihrer Funktion:
Quellen
- uniprot.org - MTOR, abgerufen am 08.03.2022
- Saxton und Sabatini mTOR Signaling in Growth, Metabolism, and Disease Cell, 2017