GTPase-aktivierendes Protein
Englisch: GTPase-activating protein, GTPase-accelerating protein
Definition
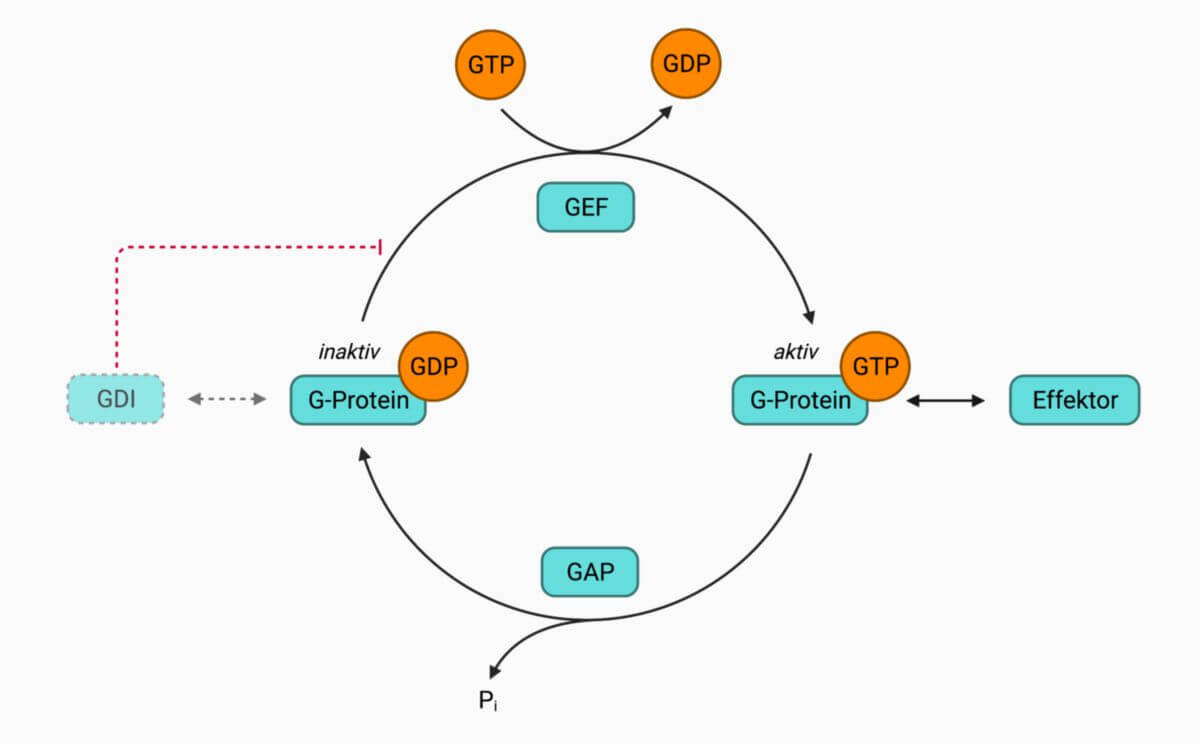
GTPase-aktivierende Proteine, kurz GAPs, unterstützen die Hydrolyse von Guanosintriphosphat (GTP) zu Guanosindiphosphat (GDP) an kleinen G-Proteinen und gelten somit als negative Regulatoren.
Hintergrund
Kleine G-Proteine bzw. GTPasen bilden eine Proteinfamilie, die bei vielen Signalwegen involviert ist. Bekannte Vertreter sind die Ras- und Rho-GTPasen. Sie werden durch Guaninnukleotid-Austauschfaktoren (GEFs) in den aktiven Zustand versetzt. GAPs unterstützen nachfolgend die GTP-Hydrolyse und versetzen die GTPase wieder in den inaktiven Zustand.
Biochemie
GAPs bestehen aus mehreren Proteindomänen. Neben der typischen GAP-Domäne, über die sie mit der GTPase interagieren, verfügen sie über weitere regulatorische und strukturelle Domänen (z.B. PH-, SH3- und PTB-Domänen). Diese variieren zwischen den verschiedenen GAPs.
Die GTP-Hydrolyse ist eine sehr langsame Reaktion, die Hydrolyserate und -geschwindigkeit kann durch GAPs jedoch stark erhöht werden. Klassische GAPs erreichen dies, indem sie spezifische Arginin- oder Asparaginreste in der GTP-Bindungsstelle der GTPase positionieren. Diese werden als "arginine finger" (engl. für "Argininfinger") bzw. "asparagine thumb" (engl. für "Asparagindaumen") bezeichnet.
Einteilung
Hinsichtlich der regulierten G-Proteine, die zur Ras-Superfamilie zählen, lassen sich die GAPs in fünf Familien einteilen:
- Ras-GAPs
- Rho-GAPs
- Rab-GAPs
- Arf-GAPs
- Ran-GAPs
Zudem existiert eine Klasse von GAPs, die heterotrimere G-Proteine regulieren und als "Regulators of G protein signaling" (RGSs) bezeichnet werden.
Quelle
- He et al. The roles of GTPase-activating proteins in regulated cell death and tumor immunity J Hematol Oncol 2021