MTOR-Komplex 2
Definition
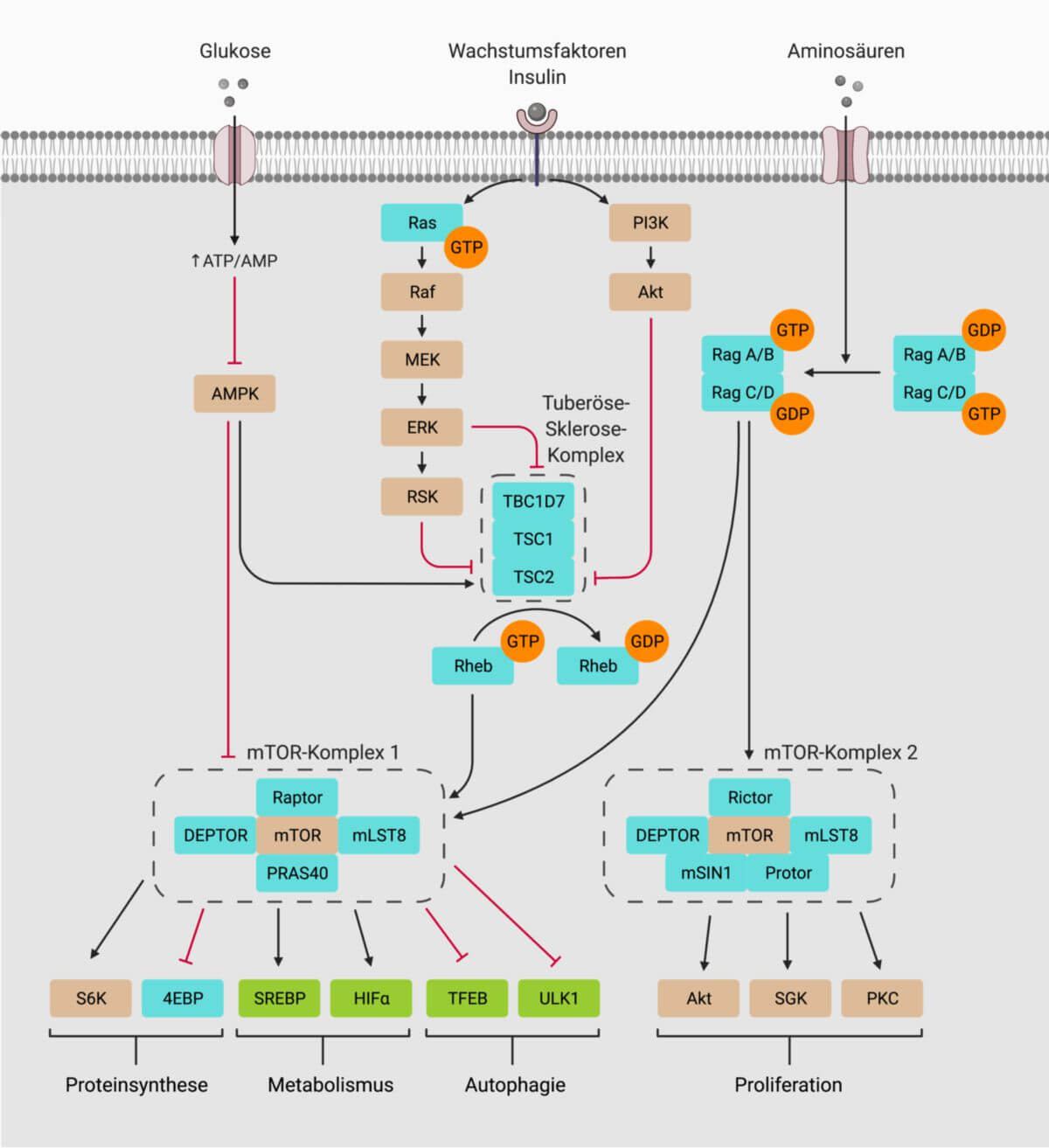
Der mTOR-Komplex 2, kurz mTORC2, ist einer der beiden Proteinkomplexe, die als zentralen Bestandteil die Serin/Threonin-Proteinkinase mTOR enthalten. mTORC2 fungiert primär als Effektor der Insulin- und Phosphoinositid-3-Kinase (PI3K)-induzierten Signalwege und reguliert somit die Proliferation und das Überleben der Zelle. mTORC2 ist durch seine Unempfindlichkeit gegenüber Rapamycin gekennzeichnet.
siehe auch: mTOR-Komplex 1
Aufbau
Proteine
mTORC1 besteht aus sechs Untereinheiten:
- mTOR (mechanistic target of rapamycin): zentraler Bestandteil mit Kinase-Aktivität
- mLST8 (mammalian lethal with Sec13 protein 8): bindet an die katalytische Domäne
- Rictor (rapamycin insensitive companion of mTOR): unterstützt die Substratbindung
- DEPTOR (DEP domain containing mTOR interacting protein): inhibitorische Untereinheit
- mSin1 (Stress-activated map kinase-interacting protein 1): unterstützt die Substratbindung
- Protor1 (prolin-rich protein 5): regulatorische Untereinheit
Struktur
mTORC2 liegt als Rhomboid-förmiges Dimer vor, dessen Zentrum durch die beiden mTOR-Moleküle gebildet wird. Im Vergleich zu mTORC1 ist die Bindungsstelle für Rapamycin durch die Rictor-Untereinheit blockiert. mLST8 ragt ähnlich wie bei mTORC1 aus dem Komplex heraus. mSin1 befindet sich in einer ausgestreckten Konformation, in der es sowohl mit Rictor, als auch mit mLST8 interagiert.
Regulation
PI3K-Aktivierung führt zur Synthese von Phosphatidylinositol-3,4,5-trisphosphat (PIP3), das an mSin1 über dessen PH-Domäne bindet und dadurch die Inhibition der katalytischen Domäne von mTOR aufhebt.
mSin1 wird zudem durch Akt phosphoryliert, wodurch eine positive Rückkopplung entsteht, die eine vollständige Aktivierung von Akt gewährleistet.
Substrate
mTORC2 phosphoryliert verschiedene Proteine der AGC-Proteinkinase-Familie (hierzu zählen u.a. PKA und PKC). Ein wichtiges Substrat ist die Kinase Akt, die wiederum u.a. den Transkriptionsfaktor FoxO1, den metabolischen Regulator GSK3b und den mTORC1-Inhibitor TSC2 aktiviert.
Quellen
- uniprot.org - MTOR, abgerufen am 08.03.2022
- Saxton und Sabatini mTOR Signaling in Growth, Metabolism, and Disease Cell, 2017
- Scaiola et al. The 3.2-Å resolution structure of human mTORC2 Sci Adv 2020