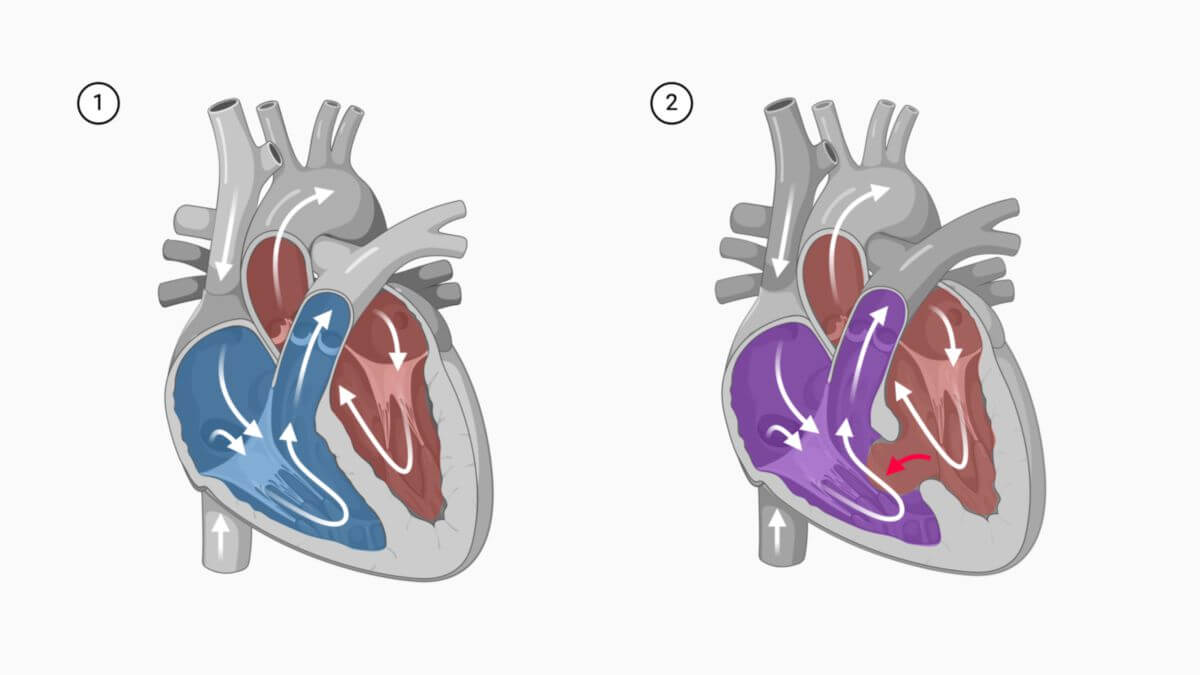
Ventrikelseptumdefekt
Synonym: Kammerseptumdefekt
Englisch: ventricular septal defect
Definition
Der Ventrikelseptumdefekt, kurz VSD, ist eine kongenitale Fehlbildung des Herzens, bei der die Scheidewand zwischen den Ventrikeln (Septum interventriculare) nicht vollständig verschlossen ist. Der Ventrikelseptumdefekt gehört zu den sogenannten Shuntvitien.
Ätiologie
Der Ventrikelseptumdefekt ist ein angeborener Herzfehler. In seltenen Fällen kann ein VSD auch sekundär als Komplikation eines Myokardinfarktes (Ventrikelseptumruptur) oder iatrogen bei kardiochirurgischen Eingriffen entstehen, z.B. im Rahmen einer transaortalen subvalvulären Myektomie.
Epidemiologie
Der VSD ist mit einem Anteil von 49 % der häufigste isolierte angeborene Herzfehler. Das entspricht einer Prävalenz von 5,27 pro 1.000 Neugeborene. Bei ca. zwei Drittel davon handelt es sich jedoch lediglich um kleine bzw. muskuläre Defekte. Es besteht eine geringfügige Prädominanz des weiblichen Geschlechts (m:w = 1:1,3). Bei 22 % der kongenitalen Ventrikelseptumdefekte liegt eine begleitende kardiale Fehlbildung vor.
Klassifikation
... nach Lokalisation
Entsprechend der Lokalisation werden folgende VSD-Typen unterschieden:
- Perimembranöser VSD (häufigste Form): Defekt befindet sich im bzw. mit Bezug zum membranösen Bereich des Septums
- Outlet-VSD: Defekt befindet sich im Auslassbereich des Septums
- Inlet-VSD: AV-Kanal-Typ
- Muskulärer VSD: Defekt befindet sich in der Pars muscularis
... nach Hämodynamik
Die Verbindung der beiden Ventrikel ist je nach Größe entweder:
- drucktrennend (Defekte < 0,5 cm²/m² KOF)
- druckreduzierend (Defekte 0,5 bis 1 cm²/m² KOF) oder
- druckausgleichend (Defekte > 1 cm²/m² KOF).
Pathophysiologie
Je nach Größe des Defekts kommt es postnatal im Rahmen des Abfalls des pulmonalen Widerstandes zu einem Links-Rechts-Shunt. Dieser führt zu einer Volumenbelastung der Pulmonalarterien, des linken Vorhofs und des linken Ventrikels. Die Folge ist die Entwicklung einer pulmonalen Hypertonie. Bei lange bestehender pulmonaler Hypertonie kann es im Rahmen einer Eisenmenger-Reaktion zu einer Shuntumkehr kommen.
Klinik
Die Symptomatik ist abhängig vom Shunt-Volumen. Kleine Defekte sind lange asymptomatisch. Große interventrikuläre Verbindungen hingegen verursachen bereits im Säuglingsalter Zeichen einer Herzinsuffizienz (Dyspnoe, Hepatomegalie, Gedeihstörung, pulmonale Infekte) und führen zu einer pulmonalen Hypertension.
Das Trinken fällt betroffenen Kindern oft schwer, nicht selten beginnen sie währenddessen zu schwitzen. Eine Shuntumkehr zeigt sich durch eine Zyanose.
Diagnostik
Auskultation
- Holosystolisches Pressstrahl-Geräusch mit p.m. über dem 3. bis 4. ICR links parasternal: wird mit zunehmender Größe des Defektes leiser
- große Defekte: evtl. diastolisches Flowgeräusch infolge der pulmonalen Hypertonie (relative Pulmonalklappeninsuffizienz) und gespaltener 2. Herzton
Aufnahme freundlicherweise zur Verfügung gestellt von 3M Littmann
EKG
- kleine Defekte: meist normal
- mittelgroße Defekte: Zeichen der Linksherzhypertrophie
- große druckgleichende Defekte: biventrikuläre Hypertrophie
- bei Shuntumkehr: Rechtsherzhypertrophie
Bildgebung
- Röntgenthorax:
- kleinere Defekte sind uncharakteristisch, sonst Zeichen der Lungenüberflutung
- ggf. Kardiomegalie
- aufgrund der Strahlenbelastung und der geringen Aussagekraft nicht routinemäßig durchgeführt
- Echokardiographie:
- Diagnosesicherung mit Nachweis des Shunts und Bestimmung der Größe und Lokalisation des Defektes
- Beurteilung der Pumpfunktion und assoziierter kardialer Fehlbildungen
- Fetale Echokardiographie:
- große Ventrikelseptumdefekte sind ggf. bereits pränatal im Organscreening (19. bis 22. SSW) nachweisbar
- bidirektionaler Shunt durch die ausgeglichenen Druckverhältnisse der Ventrikel
- Kardio-MRT:
- ggf. im Erwachsenenalter zur Quantifizierung des Shuntvolumens
Herzkatheter
Ein Herzkatheter ist in der Regel nicht zur Diagnosestellung erforderlich. Er ist erst ab sechs Monaten mit interventionellem Ansatz oder zur Bestimmung der pulmonalen Widerstandverhältnisse im Rahmen der Operationsplanung bei großen Defekten ratsam.
Differentialdiagnosen
Therapie
Die einzige Kausaltherapie ist der operative oder interventionelle Verschluss des Defektes. Ob eine solche Therapie notwendig ist, hängt von der hämodynamischen Bedeutung des VSD ab. Ein konservativ-abwartendes Regime ist in folgenden Fällen in der Regel ausreichend:
- druckausgleichender VSD
- drucktrennender VSD ohne Herzinsuffizienzzeichen und ohne linksatriale bzw. linksventrikuläre Volumenbelastung
- drucktrennender VSD ohne Herzinsuffizienzzeichen und mit linksatrialer bzw. linksventrikulärer Volumenbelastung bei Säuglingen (Alter < 12 Monate)
Grundsätzlich sollte ein VSD wegen der Möglichkeit des Spontanverschlusses erst nach dem ersten Lebensjahr elektiv operiert werden. Patienten mit großem, hämodynamisch relevantem Defekt und einer pulmonalen Hypertonie und/oder Zeichen einer Herzinsuffizienz sollten jedoch schon innerhalb der ersten sechs Monate operiert werden. Bei anatomischem Bezug zur Aortenklappe oder nach durchgemachter Endokarditis liegt ebenfalls eine Therapieindikation vor.
Chirurgische Therapie
Der chirurgische Verschluss des VSD erfolgt nach medianer Sternotomie. Minimalinvasive Alternativen sind die inferiore Teilsternotomie oder die anterolaterale bzw. posterolaterale Thorakotomie. Die Wahl des Zugangsweges hängt von der Lokalisation des Defektes ab:
- Atriotomie rechts (transatrial)
- über die Trikuspidalklappe: häufigste Methode
- über die Pulmonalklappe: bei Outlet-VSD
- Ventrikulotomie rechts (transventrikulär): bei apikal gelegenem muskulärem VSD
Ein kleiner VSD kann mittels direkter Naht verschlossen werden, während große Defekte mithilfe eines Flickens gedeckt werden. Dieser besteht entweder aus autologem Perikardgewebe, aus Dacron oder aus PTFE. Die Sterblichkeit liegt bei älteren Kindern mit unkompliziertem, isoliertem VSD um 1 %, bei Säuglingen mit bestehender Herzinsuffizienz allerdings höher. Perioperative Komplikationen, wie z.B. AV-Block, Restshunt oder Klappeninsuffizienzen, treten selten auf.
Interventionelle Therapie
Bei der kathetergestützten Methode erfolgt der Zugang transarteriell durch die Pulmonalarterie oder die Aorta. Sie kann bei geeigneten Patienten (älter als 12 Monate, Körpergewicht > 10 kg) mit muskulären oder perimembranösen VSD angewendet werden. Dabei kommen bestimmte Verschlusssysteme, wie z.B. selbstexpandierende Schirme zum Einsatz. Auch hybride Therapieverfahren aus Intervention und Operation sind möglich.
Medikamentöse Therapie
Begleitende Komplikationen wie beispielsweise die pulmonale Hypertonie und die Herzinsuffizienz sollten medikamentös behandelt werden.
Prognose
Ventrikelseptumdefekte ohne hämodynamische Relevanz haben eine gute Langzeitprognose, eine regelmäßige langfristige Kontrolle ist jedoch erforderlich. Bei ca. 30 % der Säuglinge mit VSD kommt es innerhalb der ersten beiden Lebensjahre zu einem Spontanverschluss und bei weiteren 20 % verkleinert sich der VSD. Größere VSD führen ohne Operation bei ca. 10 % der Patienten innerhalb des ersten Lebensjahres zum Tod, meist bedingt durch eine akute Linksherzinsuffizienz und rezidivierende bronchopulmonale Infekte. Weitere mögliche Komplikationen sind Endokarditiden oder Hirnabszesse.
Nach einer erfolgreichen, rechtzeitigen und komplikationslosen operativen Therapie ist die Lebenserwartung auch bei größeren VSD normal.
Literatur
- Deutsche Gesellschaft für pädiatrische Kardiologie und angeborene Herzfehler e.V., Gorenflo et al.: S2k Leitlinie: Der isolierte Ventrikelseptumdefekt abgerufen am 02.05.2022
- Herold, Innere Medizin, 2016, Gerd Herold Verlag
Bildquelle
- Bildquelle Auskultationsgeräusch: ©Pavel Danilyuk/Pexels