Imin
Synonyme: Azomethin, Schiff'sche Base
Englisch: imine
Definition
Imine sind organische Verbindungen, die eine Iminogruppe (=NH) enthalten, die mit dem benachbarten Kohlenstoffatom über eine C=N Doppelbindung verbunden ist. Sie sind Derivate von Aldehyden oder Ketonen, bei denen das Sauerstoffatom formal durch ein Stickstoffatom ersetzt ist (sog. Aza-analoge Aldehyde bzw. Ketone).
Chemie
Imine sind weniger basisch als Amine, da das freie Elektronenpaar eines sp2-hybridisierten Atoms weniger gut zur Verfügung steht als das eines sp3-hybridisierten. Sie können einer Imin-Enamin-Tautomerie unterliegen.
Imine sind etwas weniger reaktiv als das entsprechende Keton bzw. Aldehyd, weil die Elektronegativitätsdifferenz von Kohlenstoff zu Stickstoff geringer ist als die zu Sauerstoff. Sie lassen sich jedoch leichter reduzieren als Ketone.
Imine treten bei einigen Reaktionen als Zwischenprodukte auf, z.B. bei der:
- Mannich-Reaktion (Aza-analoge Carbonylkondensation)
- reduktiven Aminierung: Da sich Imine leichter als andere Carbonylverbindungen reduzieren lässt, können sie mit einem milden Reduktionsmittel wie Natriumcyanoborhydrid selektiv zu Aminen reduziert werden.
- Strecker-Synthese, über welche Aminosäuren dargestellt werden können
- Ugi-Reaktion
Da viele Arzneistoffe über Aminofunktionen verfügen, spielen Imine – vor allem im Rahmen der Mannich-Reaktion und der reduktiven Aminierung – eine wichtige Rolle in der Arzneistoffsynthese. Manche Arzneistoffe enthalten auch Iminogruppen. Dies ist zum Beispiel bei Cimetidin der Fall.
Nicht jede organische Verbindung mit einem doppelt gebundenen Stickstoff ist ein Imin. So kann das Stickstoffatom Teil einer größeren funktionellen Gruppe sein. Beispiele hierfür sind:
- Iminosäuren: Verbindungen, die neben einer Carbonsäure ein Imin aufweisen
- Amidine
- Guanidin
Darstellung
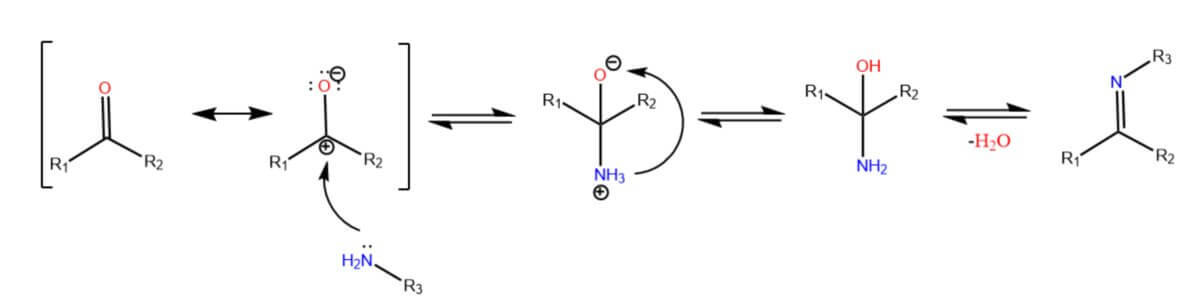
Imine entstehen aus der Reaktion einer Carbonylverbindung mit einem Amin (siehe Abbildung). Durch die höhere Elektronegativität des Sauerstoffatoms ist das Carbonyl-Kohlenstoffatom leicht positiv polarisiert, sodass an diesem eine nukleophile Substitution stattfinden kann. Das freie Elektronenpaar des Amins greift an, sodass sich intermediär ein Halbaminal bildet. Ein Proton kann vom Stickstoff- zum Sauerstoffatom wandern und als Wasser abgespalten werden. Hierbei bleibt ein Elektronenpaar zurück, das eine Doppelbindung zum Stickstoff ausbildet.
Die Reaktion erfolgt bei neutralem bis leicht sauren pH-Werten. Reaktionen an Carbonylverbindungen sind im Allgemeinen im Sauren bevorzugt, weil der Carbonyl-Sauerstoff protoniert werden kann, wodurch das Carbonyl-Kohlenstoffatom weiter polarisiert wird. Im Falle der Iminbildung wird jedoch das Amin bei zu sauren pH-Werten protoniert, sodass es seine nukleophilen Eigenschaften verliert.
Die Reaktion kann nicht mit quartären Aminen stattfinden, weil diese am Stickstoff nicht über ein freies Elektronenpaar verfügen. Bei tertiären Aminen funktioniert die Reaktion ebenfalls nicht, weil bei diesen im Produkt keine Doppelbindung ausgebildet werden kann.
Biologische Bedeutung
Die Maillard-Reaktion, bei welcher beim Kochen die typischen Röstaromen und -farben entstehen, beruht auf einer Reaktion zwischen Zuckern und Proteinen. Hierbei reagiert die Aldehyd-Funktion des Zuckers mit freien Aminogruppen eines Proteins. Nachfolgend treten weitere Umlagerungsreaktionen auf.
Die Iminogruppe von Histidin hat besondere physiologische Bedeutung, da ihr pK-Wert bei 6 liegt. Daher ist diese Aminosäure für die puffernden Eigenschaften der Proteine ausschlaggebend. Die Aminogruppen der anderen Aminosäuren haben pK-Werte zwischen 9 und 12 und ändern daher ihre Ladung bei physiologischem pH-Wert genauso wenig, wie die Carboxylgruppen (pK 2-3).
Die Glykierung entspricht einer Imin-Bildung zwischen Protein und einer reaktiven Carbonylspezies. Glykierungen können die chemische und physikalischen Eigenschaften von Proteinen verändern und die Proteinfaltung und -aggregation beeinflussen. Es können nachfolgend Umlagerungsreaktionen stattfinden, die in der irreversiblen Bildung von advanced glycation endproducts (AGEs) resultieren.
Imine können bei Proteinen auch physiologisch vorkommen. Bei diesen kann ein Substrat oder Kofaktor kovalent an das Protein binden. Ein typisches Beispiel sind Pyridoxalphosphat-abhängige Enzyme, die Transaminierungen, Decarboxylierungen und Abspaltungen organischer Reste katalysieren können. Hierbei bildet sich ein Imin als Reaktionszwischenprodukt. Ein weiteres Beispiel sind Typ-I-Aldolasen, die Aldolspaltungen katalyiseren. Sie verfügen über ein Lysin, das ein Imin mit dem Substrat bildet. Dieses Imin kann leichter gespalten werden als das Edukt. Daneben bindet Retinal in Proteine, die am Sehprozess beteiligt sind, über ein Imin.
Damit sich in Proteinen ein Imin bilden kann, muss das Lysin in deprotonierter Form vorliegen und in der Umgebung eine basische Aminosäure vorhanden sein, die das Reaktionsintermediat deprotonieren kann.
Auch für das Design von Arzneistoffen können Imine eine Rolle spielen: So können Arzneistoffe entworfen werden, die so in einer Bindetasche des Proteins zu Liegen kommen, dass sie mit einem Lysin ein Imin ausbilden können und als kovalenter Inhibitor fungieren.
Literatur
- Uceda, A. B., Mariño, L., Casasnovas, R., & Adrover, M. (2024). An overview on glycation: Molecular mechanisms, impact on proteins, pathogenesis, and inhibition. Biophysical Reviews, 16(2), 189–218.