Vorhofflimmern
Abkürzungen: VHF, AF, AFib
Englisch: atrial fibrillation
Definition
Das Vorhofflimmern, kurz VHF, ist die häufigste tachykarde Herzrhythmusstörung. Ursächlich ist eine gestörte Vorhoferregung durch Reentry-Mechanismen. Die Vorhoffrequenz liegt im Bereich von 350 bis 600 Impulsen pro Minute und ist somit höher als beim Vorhofflattern (250 bis 350/min).
- ICD10-Code: I48.0 Vorhofflimmern, paroxysmal, I48.1 Vorhofflimmern, persistierend, I48.2 Vorhofflimmern, permanent
Einteilung
...nach der Klinik
- klinisches Vorhofflimmern
- symptomatisch oder asymptomatisch
- durch ein Oberflächen-EKG dokumentiert (mindestens 30 Sekunden oder 12-Kanal-EKG)
- atriale Hochfrequenzepisoden (Atrial High-Rate Episode, AHRE)
- keine typischen Symptome
- durch implantierte Geräte (ICD, Herzschrittmacher, Ereignisrekorder) detektiert
- zuvor kein klinisches Vorhofflimmern diagnostiziert
- subklinisches Vorhofflimmern
- AHRE, die nach visueller Überprüfung als Vorhofflimmern, Vorhofflattern oder atriale Tachykardie bestätigt wurden
- im Oberflächen-EKG kein Vorhofflimmern detektierbar
...nach Zeitpunkt und Dauer
- paroxysmales Vorhofflimmern (konvertiert nach Auftreten spontan in den Sinusrhythmus)
- persistierendes Vorhofflimmern (länger als 7 Tage bestehendes, einer Therapie zugängliches Vorhofflimmern)
- lang anhaltend persistierendes Vorhofflimmern (besteht länger als ein Jahr, bevor eine Therapie eingeleitet wird)
- permanentes Vorhofflimmern (dauerhaft bestehendes, therapieresistentes, akzeptiertes Vorhofflimmern)
Ätiologie
Häufige Ursachen für ein Vorhofflimmern sind:
- Herzklappenfehler (insbesondere der Mitralklappe)
- Koronare Herzkrankheit
- Hyperthyreose
- Störungen des Elektrolythaushaltes
- Kardiomyopathien
- Sinusknotensyndrom
- vorbestehendes Vorhofflattern
- erhöhter Alkoholkonsum bzw. Alkoholintoxikation
- Infektionen
- Thoraxtrauma
- Herzchirurgischen Eingriffen
- Arterielle Hypertonie
- Schlafapnoesyndrom
Bei ungefähr der Hälfte der Fälle ist die Ätiologie unklar, man bezeichnet diese Fälle daher als idiopathisch.
Pathophysiologie
Für das Vorhofflimmern werden multiple Reentry-Kreisläufe des Erregungsleitungssystems auf Vorhofebene verantwortlich gemacht. Zudem wird angenommen, dass sogenannte Trigger aus den Lungenvenen auf den linken Vorhof treffen und das Vorhofflimmern induzieren. Die unkoordinierten Vorhofaktionen werden bei normaler Leitfähigkeit des AV-Knotens tachykard auf die Kammern übergeleitet. Gleichzeitig besteht eine absolute Arrhythmie, sodass zusammenfassend meistens eine Tachyarrhythmia absoluta festzustellen ist. Eine Ausnahme bildet das Vorhofflimmern bei gleichzeitigem AV-Block 3. Grades, das durch einen langsamen Kammerersatzrhythmus gekennzeichnet ist.
Die Hämodynamik ist durch das Vorhofflimmern beeinträchtigt. Durch die Tachykardie der Kammern, die bei körperlicher Belastung noch weiter zunimmt, ist die Auswurfleistung beeinträchtigt. Bei dauerhaft tachykarder Überleitung kann es zur Schädigung des Myokards kommen. In ausgeprägten Fällen kann sich das Bild einer Tachykardiomyopathie mit Herzinsuffizienz entwickeln. Weiterhin ist das Ausbleiben der mechanischen Vorhofaktion dafür verantwortlich, dass die diastolische Füllung des Ventrikels um etwa ein Fünftel vermindert ist. Dies wirkt sich ebenfalls negativ auf das Schlagvolumen aus.
Durch die uneffektive Kontraktion der Vorhöfe kommt es zu einer Stase von Blut, die zur Bildung eines Thrombus mit Verschleppung (Embolie) führen kann. Das Thromboembolierisiko ist nach 48 Stunden bestehendem Vorhofflimmern stets als erhöht zu betrachten. Das Risiko für einen Schlaganfall kann mittels CHA2DS2-VASc-Score berechnet werden.
Diagnostik
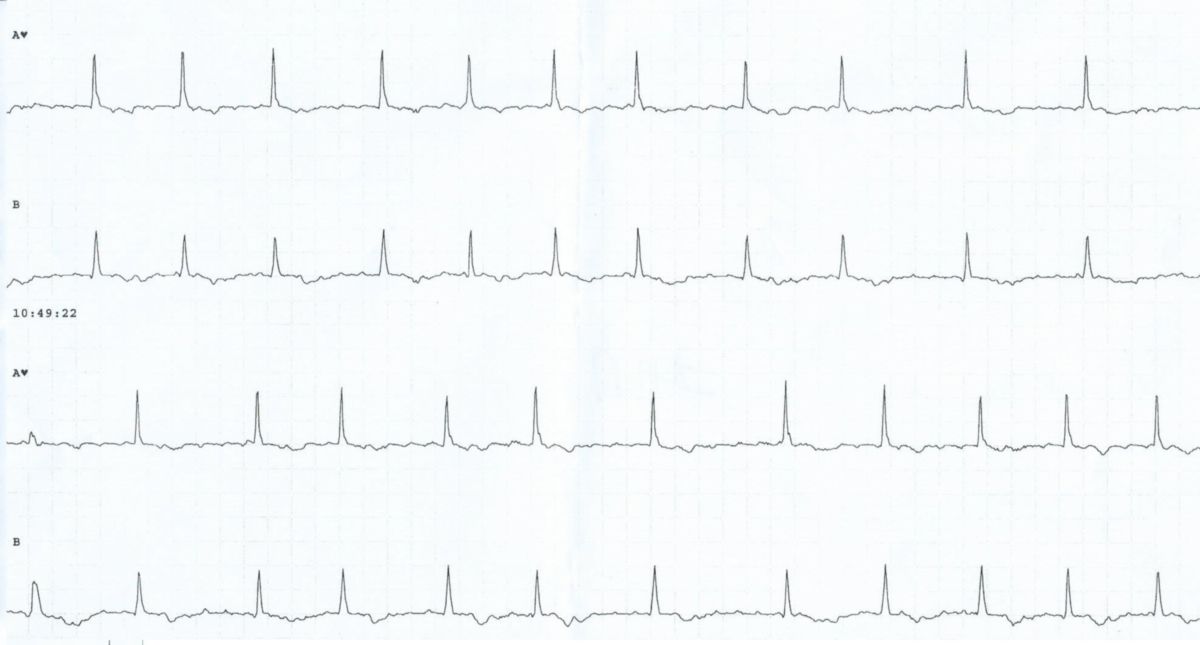
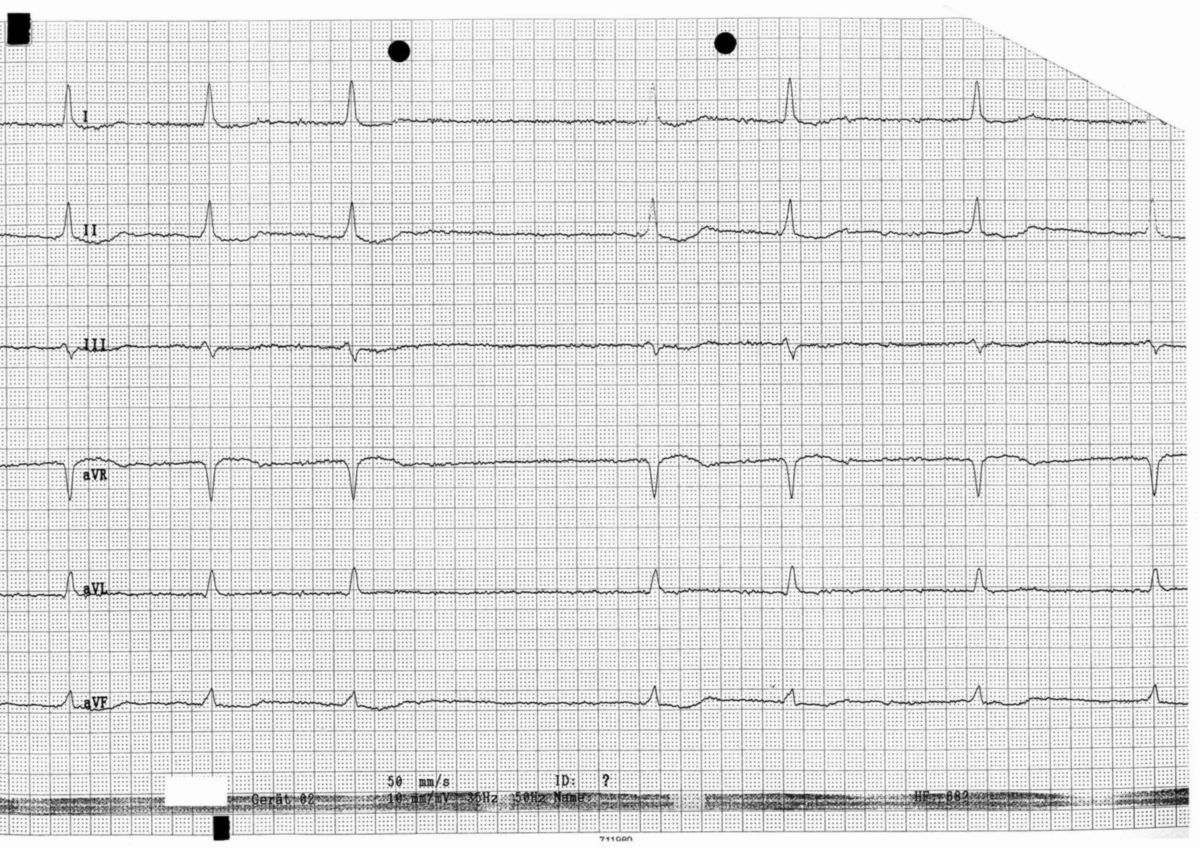
Für die Diagnostik des Vorhofflimmerns ist eine Dokumentation mittels Elektrokardiogramm (EKG) unerlässlich. Insbesondere der Nachweis von paroxysmalem Vorhofflimmern kann jedoch schwierig sein. Sollte ein Ruhe-EKG nicht ausreichend sein, kommen Langzeit-EKGs oder Eventrekorder zum Einsatz. Auch die Aufzeichnung durch entsprechend ausgerüstete Wearables (z.B. Smartwatches) kann wichtige Hinweise liefern.
EKG
Im EKG kommt es zu einem typischen Bild mit:
- Flimmerwellen als Ausdruck einer völlig unkoordinierten Vorhoferregung (keine P-Wellen)
- absoluter Arrhythmie des Herzen aufgrund einer unregelmäßigen Überleitung (unregelmäßige RR-Intervalle)
In der Regel liegen schmale QRS-Komplexe vor. Bei aberranter Weiterleitung können auch breite QRS-Komplexe auftreten, z.B. als Ausdruck des Ashman-Phänomens.
Klinische Symptomatik
Abhängig von der auf die Kammern übergeleiteten Frequenz kommt es vor allem bei Tachykardie zu Palpitationen und Wahrnehmung einer unregelmäßigen Herzaktion. Die körperliche Belastbarkeit ist vermindert, beim Versuch kommt es zu Dyspnoe. Bei der Auskultation und dem Tasten des Pulses kann neben der Arrhythmie auch ein Pulsdefizit offenbar werden. Durch erhöhte ANP-Sekretion kommt es gehäuft zu einer Polyurie. Auch weitere vegetative Symptome werden beschrieben, wie z.B. Schweißausbruch, Zittern, Übelkeit und Erbrechen.
Neben der oben genannten Tachykardie kann es auch zu einer Bradyarrhythmia absoluta mit einer Herzfrequenz von unter 60/Minute kommen. Ein Teil der Patienten verspürt unter Vorhofflimmern keine Symptome.
EHRA-Klassifikation
Angelehnt an die NYHA-Klassifikation bei Herzinsuffizienz kann die Schwere der Symptomatik des Vorhofflimmerns nach dem EHRA-Score der European Heart Rhythm Association (EHRA) eingeteilt werden. Dieser Score wird als Entscheidungshilfe für die Indikation zur rhythmuserhaltenden Therapie herangezogen.[1]
| Score | Symptome | Beschreibung |
|---|---|---|
| 1 | keine | Das Vorhofflimmern verursacht keinerlei Beschwerden. |
| 2a | leicht | Die normale Alltagstätigkeit ist durch die Symptome des Vorhoffflimmerns nicht beeinträchtigt. |
| 2b | mittelschwer |
Die normale Alltagstätigkeit ist durch die Symptome des Vorhoffflimmerns nicht beeinträchtigt, die Patienten sind aber durch die Symptome verunsichert und beunruhigt. |
| 3 | schwer | Normale Alltagstätigkeiten sind durch die Symptome des Vorhoffflimmerns beeinträchtigt. |
| 4 | behindernd | Normale Alltagstätigkeiten sind nicht mehr möglich. |
Komplikationen
Selten kann ein Vorhofflimmern in ein Kammerflimmern übergehen. Ursächlich hierfür ist in der Regel das Vorliegen einer akzessorischen Leitungsbahn. Eine häufigere Komplikation ist die intrakardiale Ausbildung von Thromben mit dem Resultat einer Thrombembolie. Des Weiteren ist die Herzinsuffizienz eine wichtige Komplikation des Vorhofflimmerns. Diese Verdachtsdiagnose wird meist anhand des klinischen Erscheinungsbildes gestellt und durch eine Echokardiographie bestätigt.
Die Komplikationsrate hängt maßgeblich von der Ursache des Vorhofflimmerns ab. So ist z.B. das Risiko einer Thrombembolie bei Patienten mit Mitralklappenfehlern oder Zustand nach Mitralklappenersatz besonders hoch. Das Risiko für die Entwicklung eines Kammerflimmerns ist bei vorliegender koronarer Herzkrankheit und Kardiomyopathien erhöht.
Das Schlaganfallrisiko eines Patienten lässt sich mit Hife des CHADS2-Scores abschätzen.
Therapie
Akuttherapie
Als akute Erstmaßnahme sollte nach Diagnosestellung eine ausreichende Antikoagulation zunächst mit Heparin, später bzw. parallel einsetzend Umstellung auf orale Antikoagulation (Cumarin-Derivate oder direkte orale Antikoagulantien) erfolgen. Bei Patienten mit niedrigem CHA2DS2-VASc-Score (Männer 0, Frauen 1) besteht nach derzeitigen Wissensstand keine Indikation zur dauerhaften Antikoagulation.
Anschließend ist eine Senkung (Normalisierung) der Herzfrequenz anzustreben. Zu diesem Zweck werden bevorzugt Calciumantagonisten, Digitalisglykoside und Betablocker eingesetzt, zur Konversion eines kürzlich aufgetretenen Vorhofflimmerns ist Vernakalant zugelassen. Zudem stehen die klassischen Antiarrhythmika zur Verfügung. Die Serumspiegel von Kalium und Magnesium sollten im hochnormalen Bereich eingestellt werden.
Mit dem Vorhofflimmern in Zusammenhang stehende oder die Komplikationsrate erhöhende Grunderkrankungen (Herzinsuffizienz, Hyperthyreose, hypertensive Krise) sollten möglichst optimal eingestellt werden.
Falls die Auswurfleistung des linken Ventrikels hochgradig eingeschränkt ist und das Vorhofflimmern akut eingetreten ist, ist eine sofortige elektrische Kardioversion indiziert.
Dauertherapie
Bei der Dauertherapie des Vorhofflimmerns ist zwischen einer Rhythmuskontrolle und einer Frequenzkontrolle zu entscheiden.
Die Rhythmuskontrolle bietet den Vorteil der Wiederherstellung des Sinusrhythmus und der damit verbundenen vollständigen Besserung des Allgemeinbefindens. Sie ist dann anzustreben, wenn das Vorhofflimmern erstmalig oder im Rahmen eines akuten Zustandes (z.B. thyreotoxische Krise) auftritt und zum Zeitpunkt der Diagnose keine Dilatation des linken Vorhofs nachzuweisen ist.
Eine Frequenzkontrolle ist demgegenüber bei chronischem Vorhofflimmern (> 6 Monate), Rezidiven nach vorheriger Kardioversion und subjektiv nicht stark empfundener Beeinträchtigung des Patienten anzustreben.
Rhythmuskontrolle
Zur Rhythmuskontrolle stehen zwei Verfahren zur Verfügung: Die externe elektrische Kardioversion mit EKG-gesteuertem Setzen eines Gleichstromimpulses auf den Brustkorb bietet bei Erstanwendung die höchsten Erfolgsraten. Nachteil ist eine höhere Komplikationsrate (Thrombembolie, Narkose). Vor der elektrischen Kardioversion muss der Patient über einen Zeitraum von vier Wochen vor und vier Wochen nach der Therapie mit Cumarinen antikoaguliert werden (INR 2-3). Alternativ kann eine elektrische Kardioversion auch nach Ausschluss eines Thrombus mittels TEE unter Heparinisierung stattfinden.
Zur medikamentösen Rhythmuskontrolle ist das Antiarrhythmikum Amiodaron erste Wahl. Prinzipiell sind alle Antiarrhythmika der Klasse I (z.B. Propafenon, Flecainid) und III (z.B. Sotalol) zur medikamentösen Rhythmuskontrolle geeignet, sind nach derzeitiger (2022) Kenntnis jedoch aufgrund ihrer proarryhthmogenen Wirkung zurückhaltend anzuwenden.
Die Rezidivrate nach Wiederherstellung des Sinusrhythmus beträgt im ersten Jahr über 70 %. Eine Rezidivprophylaxe mit Amiodaron kann die Rezidivrate auf 50 % senken, ist jedoch bei Dauertherapie mit unangenehmen Nebenwirkungen verbunden. Daher werden zur Rezidivprophylaxe häufiger Betablocker angeordnet, die nicht gleich effektiv wirken, bei Patienten mit Herzinsuffizienz, KHK und Hypertonus aber zusätzlich die Prognose bezüglich der Mortalität bessern.
Frequenzkontrolle
Zur Frequenzkontrolle eignen sich prinzipiell die in der Akuttherapie zur Frequenznormalisierung eingesetzten Medikamente.
- Digitalisglykoside senken die Herzfrequenz über indirekte Stimulation des Nervus vagus
- Calciumantagonisten senken die Aufstiegsgeschwindigkeit der diastolischen Depolarisation in Zellen des Erregungsleitungssystems
- Betablocker wirken über eine Blockade von Betarezeptoren negativ chronotrop
Meistens wird ein Betablocker verwendet, da mit ihnen die Herzfrequenz auch unter Belastung zufriedenstellend eingestellt ist.
Interventionelle Verfahren
Bei Nichtansprechen auf eine der genannten Therapieformen besteht als ultima ratio die Möglichkeit einer AV-Knotenablation per Herzkatheter. Dieses Vorgehen impliziert jedoch die Anlage eines permanenten Herzschrittmachers, da durch die Intervention die Überleitung von Vorhof auf die Ventrikel zerstört wird. Dieses Vorgehen wird auch als Pace-and-Ablate-Strategie bezeichnet.
Ein weiteres mittlerweile gut etabliertes Verfahren stellt die Pulmonalvenenisolation (PVI) dar, deren Ziel es ist, die vollständige elektrische Diskonnektion aller Pulmonalvenen zu erreichen, die elektrische Potentiale zeigen.
Quellen
- ↑ P Kirchhoff et al.: Kommentar zu den Leitlinien der ESC zum Vorhofflimmern. Der Kardiologe. 6, 2012, S. 12–27.
Literatur
- Deutsche Gesellschaft für Kardiologie: Pocket-Leitlinie: Diagnose und Behandlung von Vorhofflimmern Version 2020