Cobalamin
Synonyme: Vitamin B12, Extrinsic Factor, Extrinsic-Faktor, Antiperniziosa-Faktor, Coenzym B12
Englisch: cobalamin, vitamin B12
Definition
Cobalamine sind wasserlösliche Vitamine, die dem so genannten Vitamin-B-Komplex angehören. Sie bestehen aus einem Corrinringsystem mit vier Pyrrolringen, die um ein zentrales Cobalt-Ion gelagert sind.
Chemie
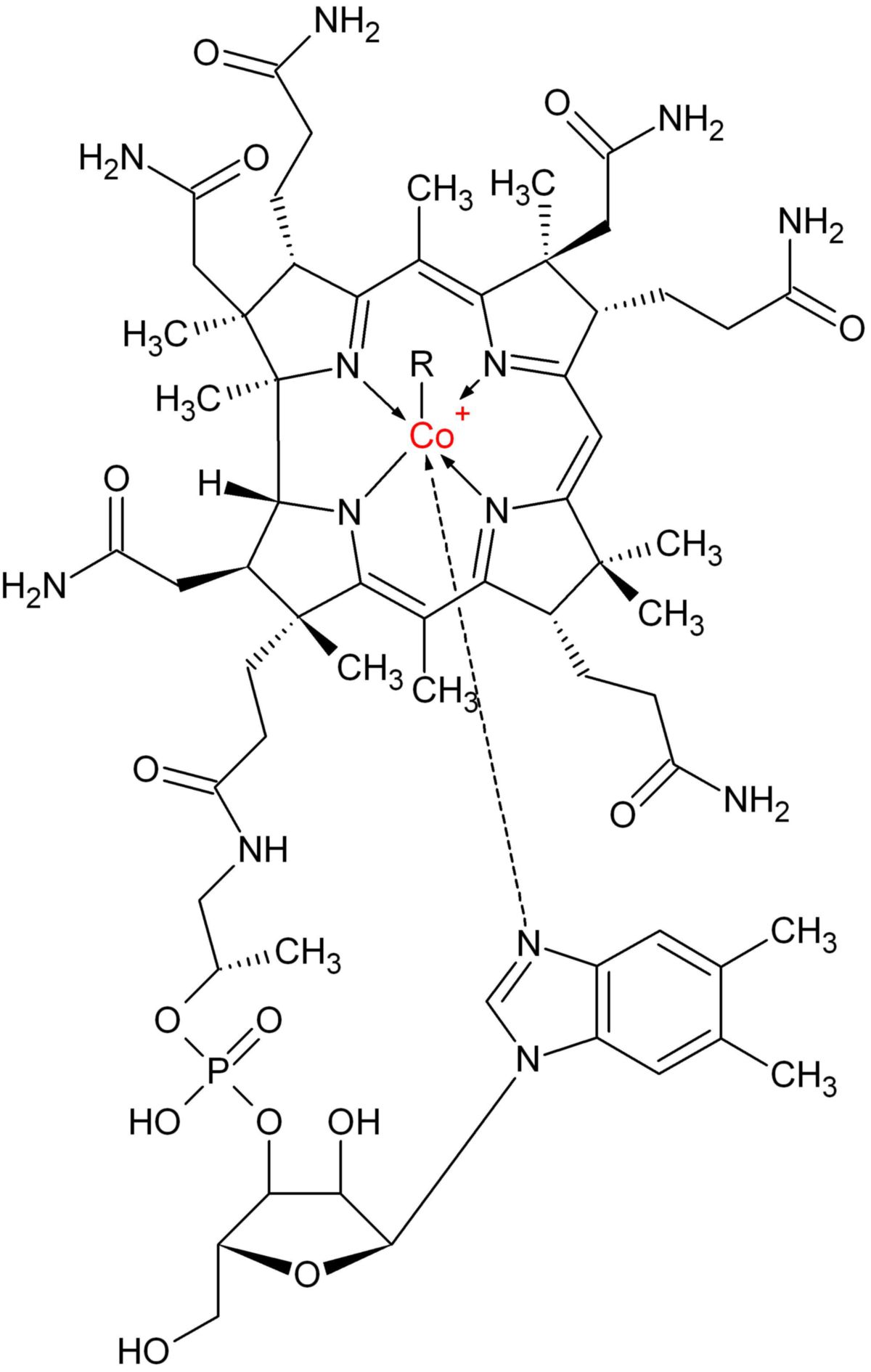
Die chemische Bezeichnung (IUPAC-Name) für Cobalamin ist α-(5,6-Dimethylbenzimidazolyl)-cobamidcyanid. Die Summenformel lautet C62H88CoN13O14P.
Cobalamin ist das chemisch komplexeste Vitamin. Es basiert auf einem Corrinring, der dem Porphyrinring des Häms ähnelt. Sein zentrales Metallion ist Cobalt. Vier der sechs koordinativen Bindungen des Cobalts werden vom Corrinring gestellt, die 5. von einer Dimethylbenzimidazol-Gruppe. Die 6. koordinative Bindung ist variabel. Es kann sich z.B. um eine Cyanogruppe (–CN), eine Hydroxylgruppe (–OH), eine Methylgruppe (–CH3) oder eine 5′-Deoxyadenosylgruppe handeln.
Neuere Untersuchungen (2019) zeigen, dass Enzyme, die Cobalamin als Cofaktor verwenden, quantenmechanische Effekte nutzen, um die Reaktivität der am Cobalt-Atom gebundenen Radikale zu unterdrücken. Dadurch wird die volle Reaktivität des Radikals erst entfaltet, wenn sich das Enzym in unmittelbarer Nähe seines Substrats befindet. Auf diese Weise wird eine Schädigung anderer Zellbestandtetile durch hochreaktive Cobalamin-Liganden verhindert.[1]
Erläuterung: das Cobaltatom ist zur besseren Erkennung rot dargestellt. Der daran befindliche Rest "R" bedeutet im Einzelnen:
R = -CN: Cyanocobalamin, Vitamin B12
R = H2O: Aquocobalamin, Vitamin B12a
R = -OH: Hydroxocobalamin, Vitamin B12b
R = -CH3: Methylcobalamin, MeB12
Biochemie
Die verschiedenen Formen des Cobalamins werden nach dem Bindungspartner der 6. koordinativen Bindung benannt. Liegt eine Cyanogruppe vor, spricht man von Cyanocobalamin, wenn es sich um eine Hydroxylgruppe handelt, liegt Hydroxocobalamin vor, usw.
Die zwei enzymatisch aktiven Formen des Cobalamins im Körper sind:
- 5′-Desoxyadenosylcobalamin (AdoCbl) in Mitochondrien vieler Zellen: Diese Form ist Kofaktor für die Methylmalonyl-CoA-Mutase. Sie baut Thymin, Valin, Isoleucin, Methionin, Threonin und ungeradzahlige Fettsäuren über Methylmalonyl-CoA zu Succinyl-CoA ab.
- Methylcobalamin (MeCbl), z.B. beim Menschen im Blutplasma und im Zytoplasma der Zelle. Diese Form ist Kofaktor für die Methioninsynthase, welche vor allem im Folsäurestoffwechsel Homocystein zu Methionin umwandelt.
Cobalamin ist sekundär an vielen wichtigen Stoffwechselwegen der Fettsäuren, Aminosäuren und Nukleinsäuren beteiligt und hat damit einen wichtigen Einfluss auf die Hämatopoese, die Myelinsynthese und die Synthese von epithelialen Geweben.
Vorkommen
Cobalamin wird von Mikroorganismen synthetisiert, vor allem von Bakterien. Die wichtigste Quelle für den Menschen sind tierische Lebensmittel (Fleisch, Fisch, Milchprodukte, Eier). In herkömmlicher pflanzlicher Nahrung ist es nur in Spuren vorhanden, kann aber durch bakteriell erzeugte Ergänzungsprodukte in Form von Methyl- oder Cyanocobalamin supplementiert werden.
Bedarf
Im Rahmen einer ausgewogenen Ernährung nimmt man durchschnittlich 5 bis 30 µg Cobalamin pro Tag zu sich. Der tägliche Verlust über Urin und Fäzes beträgt 1 bis 3 µg. Der Körpervorrat in der Leber und zum Teil in der Muskulatur beträgt insgesamt 2 bis 3 mg. Somit entsteht ein täglicher Bedarf von ungefähr 1 bis 3 µg. Bei komplett unterbundener Zufuhr würde der Gesamtvorrat im Körper etwa 3 bis 4 Jahre ausreichen.
Resorption
Cobalamin kann passiv über die Schleimhaut im Mund und Darm aufgenommen werden. Diese schnelle Resorption ist jedoch sehr ineffizient, sodass weniger als 1 % einer oralen Dosis aufgenommen werden. Daher wird Cobalamin zusätzlich aktiv im Ileum resorbiert. Dazu wird nutritiv zugeführtes Cobalamin aus Nahrungsproteinen durch Enzyme im Magen und Darm freigesetzt. Zunächst geht es in Verbindung mit Haptocorrinen des Speichels ein. Im Dünndarm wird Haptocorrin durch pankreatisches Trypsin verdaut und Cobalamin auf den Intrinsic Factor übertragen. Dieser wird in den Parietalzellen des Magenfundus und -korpus synthetisiert und begleitend zur Salzsäure sezerniert. Der IF-Cobalamin-Komplex ist resistent gegen proteolytische Zersetzung und bindet im Ileum an den Rezeptor Cubilin. In den Enterozyten des Ileums wird Intrinsic Factor aus dem Komplex entfernt. Nach durchschnittlich sechs Stunden erscheint Cobalamin an Transcobalamin II gebunden als Holo-Transcobalamin im portalvenösen Blut.
Täglich werden 0,5 bis 5 µg Cobalamin über die Galle ausgeschieden. Ein Großteil wird zusammen mit Cobalamin aus abgestoßenem Darmepithel wieder reabsorbiert. Dieser enterohepatische Kreislauf erklärt, warum sich ein Cobalaminmangel schneller bei Malabsorption als bei Ernährungsdefiziten entwickelt.
Transport
Cobalamin wird durch zwei Proteine transportiert:
- Transcobalamin I (Haptocorrin) wird durch das Gen TCN1 auf Chromosom 11 (Genlokus 11q11-q12.3) kodiert. Es stammt primär aus spezifischen Granula der neutrophilen Granulozyten. Zwei Drittel sind normalerweise mit Cobalamin gesättigt. Es befördert überschüssiges Cobalamin aus dem Plasma zur Leber, wo es gespeichert wird.
- Transcobalamin II wird durch das Gen TCN2 auf Chromosom 22 (Genlokus 22q11-q13.1) kodiert. Es wird in der Leber, im Ileum, Gefäßendothel und Makrophagen synthetisiert. Normalerweise befördert es nur 20 bis 60 ng Cobalamin pro Liter Plasma und gibt es dann an Knochenmark, Plazenta und andere Gewebe ab. Der entsprechende Rezeptor ist Megalin.
Klinik
Ein Cobalamin-Defizit wird als Vitamin-B12-Mangel bezeichnet. Meistens liegt eine Resorptionsstörung vor, die durch einen Mangel an Intrinsic factor bedingt ist. Mögliche Ursachen hierfür sind
- Schleimhautatrophien im Bereich des Magenfundus im Rahmen einer chronischen Gastritis (perniziöse Anämie),
- Auftreten von Antikörpern gegen den Intrinsic Factor oder Parietalzellen
- Zustand nach Gastrektomie oder ein
- kongenitales Fehlen des Intrinsic Factors.
Weitere möglichen Ursachen sind ein Morbus Crohn, ein Blindsack-Syndrom mit bakterieller Fehlbesiedlung im Dünndarm, eine Ileumresektion, Fischbandwurm-Befall, schwere chronische Leber- oder Nierenerkrankung und verschiedene seltene Erkrankungen. Auch bestimmte Medikamente können einen Vitamin-B12-Mangel auslösen, z.B. H2-Rezeptorantagonisten, Protonenpumpenhemmer oder Metformin. Selten kann ein Vitamin-B12-Mangel durch eine fehlende nutritive Zufuhr bei strengem Veganismus entstehen.
Ein Vitamin-B12-Mangel äußert sich durch Störungen der Blutbildung (megaloblastäre Anämie) und/oder durch neurologische bzw. neuropsychiatrische Symptome. Die funikuläre Myelose beschreibt eine ausgeprägte neurologische Erkrankung, die auch ohne begleitende hyperchrome makrozytäre Anämie auftreten kann.
Des Weiteren kann es auch zu einer Methylmalonylazidurie kommen. Cobalamin fehlt der Methylmalonyl-CoA-Mutase bei der Umwandlung von Methylmalonyl-CoA zu Succinyl-CoA im Aminosäurestoffwechsel und beim Abbau ungeradzahliger Fettsäuren. Dadurch reichert sich Methylmalonyl-CoA im Blut an und wird verstärkt mit dem Urin ausgeschieden. Bei einem isolierten Folsäuremangel (ebenfalls klinisches Bild einer megaloblastären Anämie) würde dies nicht auftreten.
An der Regeneration von 5-Methyltetrahydrofolat (N5-MeTHF) zu Tetrahydrofolat (THF) sind die Methioninsynthase und Homocystein beteiligt. Dieses Enzym ist aber wiederum abhängig von Cobalamin, sodass ein Mangel zu einem Anstieg von Homocystein und Methyltetrahydrofolat führen kann. Durch eine Supplementierung von Folsäure kann so der eigentliche Cobalaminmangel verdeckt werden. Die Homocystinurie ist ein Risikofaktor für kardiovaskuläre Erkrankungen.
siehe Hauptartikel: Vitamin-B12-Mangel
Labormedizin
Beim Vorliegen einer megaloblastären Anämie, im Rahmen von Malabsorptionssyndromen oder bei funikulärer Myelose kann die Bestimmung des Serumspiegels für Cobalamin indiziert sein.
Der Schilling-Test mit oraler Verabreichung von radioaktiv markiertem Vitamin B12 und anschließender Messung der Urinausscheidung wird heute (2021) nur noch selten durchgeführt.
Material
Zur labormedizinischen Bestimmung des Serumspiegels für Cobalamin werden 2 ml Serum benötigt. Dabei sollte darauf geachtet werden, dass nach der Blutentnahme die Monovette lichtgeschützt (bspw. in Alufolie gewickelt) ins Labor transportiert wird, da sonst falsch-niedrige Werte die Folge sein könnten.
Referenzbereich
- Vitamin-B12-Mangel: < 200 ng/l
- nicht beurteilbar: 200 - 300 ng/l
- Normalwert: > 300 ng/l
- V.a. Hypervitaminose: > 1.100 ng/l
Die genauen Referenzbereiche sind methodenabhängig und sollten dem jeweiligen Befundausdruck entnommen werden.
Interpretation
Der Serumspiegel für Cobalamin ist stark abhängig von den Ernährungsgewohnheiten und liegt bei Vegetariern deutlich niedriger als bei Nicht-Vegetariern.
Hohe Vitamin-B12-Spiegel kommen unter anderem bei Einnahme oder Injektion von Vitamin-B12-Präparaten, hämatologischen Erkrankungen (MDS, Polycythaemia vera, AML M3, Hypereosinophilie), akuter und chronischer Hepatitis, Tumorleiden (insbesondere Leberzellkarzinome und Lebermetastasen) sowie Niereninsuffizienz vor. Ein hoher Vitamin-B12-Spiegel kann auch bei gleichzeitigen Symptomen eines Vitamin-B12-Mangels vorkommen. Die Ursache kann ein erhöhter Spiegel von Transcobalamin mit verstärkter Bindung von Vitamin B12 im Plasma sein. Bei Überdosierung von Vitamin-B12-Präparaten kann es zu allergischen Reaktionen kommen.
Die alleinige Messung und Betrachtung des Gesamt-Vitamin B12 gibt keine zuverlässige Auskunft darüber, ob ein Mangel an Vitamin B12 vorliegt. Gute Frühindikatoren für einen Vitamin-B12-Mangel sind erhöhte Spiegel von Homocystein und Methylmalonsäure im Serum, sowie ein erhöhtes MCV.
Literatur
- Laborlexikon.de; abgerufen am 21.04.2021
Quellen
- ↑ Khalilian Boroujeni, M. Hossein: Quantum effects in adenosylcobalamin-dependent enzymes, University of British Columbia 2019, abgerufen am 12.8.2019