Pyrimidinbiosynthese
Synonyme: De-novo-Pyrimidinsynthese, Pyrimidinnukleotidsynthese
Englisch: pyrimidine biosynthesis
Definition
Die Pyrimidinbiosynthese ist ein Stoffwechselweg, der die Biosynthese des Pyrimidinrings der Basen Uracil, Thymin und Cytosin und ihrer Derivate ermöglicht.
Biochemie
Bei der Pyrimidinbiosynthese wird, im Gegensatz zur Purinbiosynthese, zuerst der Ring synthetisiert und anschließend der Ring mit der Ribose verbunden. Der Pyrimidinring wird zusammengesetzt aus:
- Ammoniak (aus Glutamin)
- Hydrogencarbonat (HCO3-)
- Aspartat
Um die Synthese des Rings zu ermöglichen, ist das multifunktionelle Enzym CAD notwendig. Dieses besteht aus folgenden Komponenten:
- C: Glutamin-abhängige Carbamoylphosphat-Synthetase II (CPS2)
- A: Aspartat-Carbamoyltransferase
- D: Dihydroorotase
CPS2
Die ersten drei Reaktionsschritte werden durch CPS2 katalysiert. Dieses Enzym besitzt drei katalytische Zentren, die eng zusammenarbeiten:
| Zentrum | Reaktion | Beschreibung |
|---|---|---|
| 1 | Glutaminhydrolyse | Glutamin wird zu Glutamat und Ammoniak hydrolysiert. |
| 2 | Hydrogencarbonatphosphorylierung | Hydrogencarbonat (HCO3-) wird unter ATP-Verbrauch zu Carboxyphosphat (HOCO2-PO32-) phosphoryliert. Dieses reagiert unverzüglich mit Ammoniak zu Phosphat und Carbaminsäure. |
| 3 | Carbaminsäurephosphorylierung | Carbaminsäure wird unter ATP-Verbrauch zu Carbamoylphosphat phosphoryliert. |
CPS2 unterliegt einer allosterischen Endprodukthemmung durch UTP. Aktiviert wird die CPS2 durch Phosphoribosylpyrophosphat (PRPP). Wird das Enzym jedoch MAP-Kinase-abhängig phosphoryliert, reagiert es verstärkt auf die Stimulierung und verliert somit die Rückkopplungshemmung durch UTP. Außerdem ist die Pyrimidinsynthese mit dem Zellwachstum gekoppelt, da der MAP-Kinase-Signalweg die Zelle zur Proliferation bringt.
Cave: CPS2 darf nicht mit der mitochondrialen Carbamoylphosphat-Synthetase I (CPS1) verwechselt werden. Die CPS1 ist nämlich ein Bestandteil des Harnstoffzyklus und benutzt Ammoniak als Substrat. CPS2 hingegen setzt Ammoniak aus Glutamin frei.
Reaktionsschritte
Schritt 1
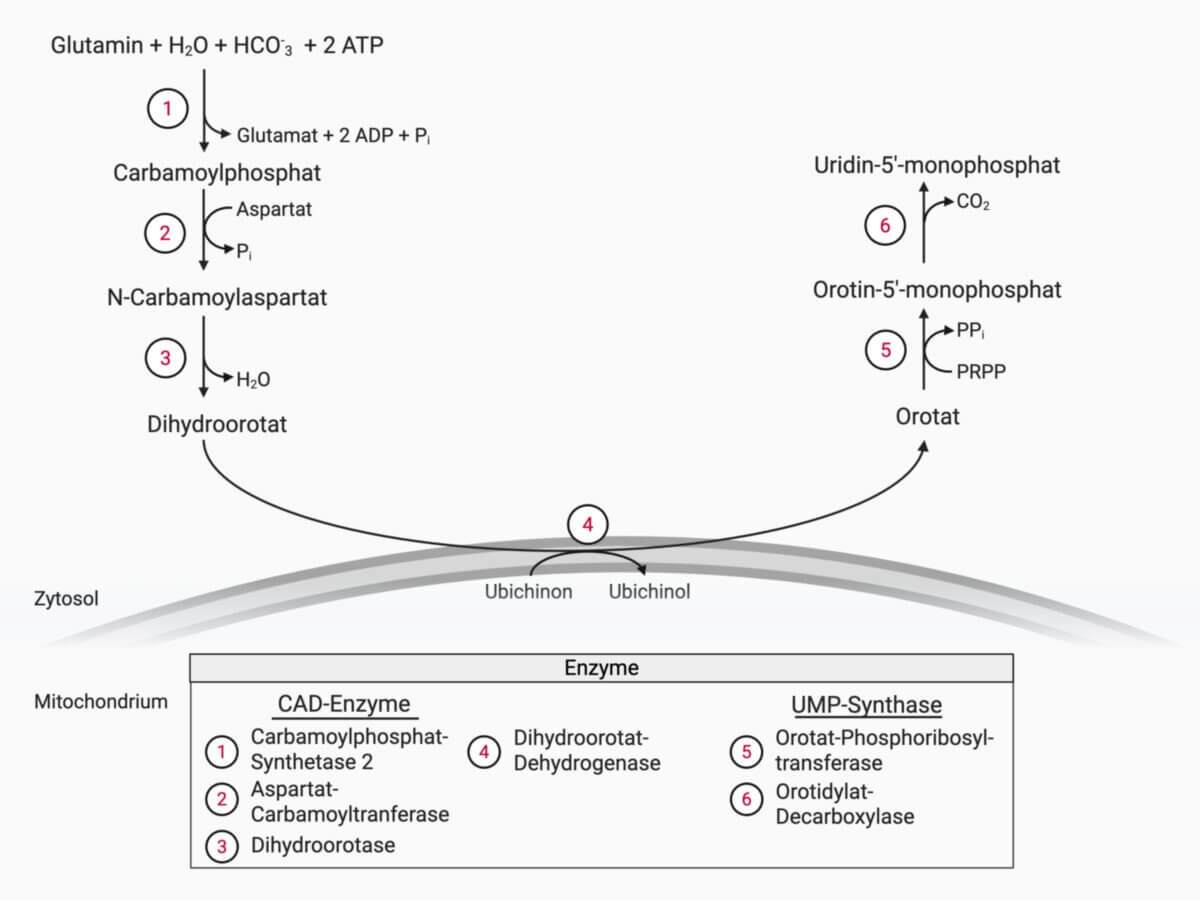
Die Synthese der Pyrimidinnukleotide erfolgt in mehreren aufeinanderfolgenden Reaktionsschritten und mündet schließlich in der Bildung von Uridin-5'-monophosphat (UMP). Der Prozess beginnt im Zytoplasma mit der Bildung von Carbamoylphosphat aus Glutamin, Wasser, Bicarbonat und zwei Molekülen ATP. Diese Reaktion wird von CPS2 katalysiert.
Schritt 2
Im nächsten Schritt reagiert das Carbamoylphosphat mit Aspartat zu N-Carbamoylaspartat. Diese Reaktion wird durch die Aspartat-Carbamoyltransferase vermittelt.
Schritt 3
Anschließend erfolgt durch Dihydroorotase die zyklische Schließung unter Abspaltung von Wasser, wodurch Dihydroorotat entsteht. Mit diesem dritten Schritt endet die Aktivität des multifunktionellen CAD-Enzyms.
Schritt 4
Die Synthese wird durch die Dihydroorotat-Dehydrogenase fortgesetzt, die im Gegensatz zu den übrigen zytosolischen Enzymen in der inneren Mitochondrienmembran lokalisiert ist. Dort wird Dihydroorotat unter Beteiligung von Ubichinon zu Orotat oxidiert. Die entstehenden Elektronen werden über FMN auf Ubichinon übertragen, das zu Ubichinol reduziert wird. Die Elektronen gelangen dann weiter zum Komplex III der Atmungskette und tragen so zur oxidativen Phosphorylierung bei.
Schritt 5
Orotat wird anschließend unter Verwendung von PRPP durch die Orotat-Phosphoribosyltransferase in Orotidin-5'-monophosphat (OMP) überführt. Dabei wird Pyrophosphat freigesetzt, das rasch zu zwei Phosphaten hydrolysiert wird, was die Reaktion in Richtung OMP begünstigt.
Schritt 6
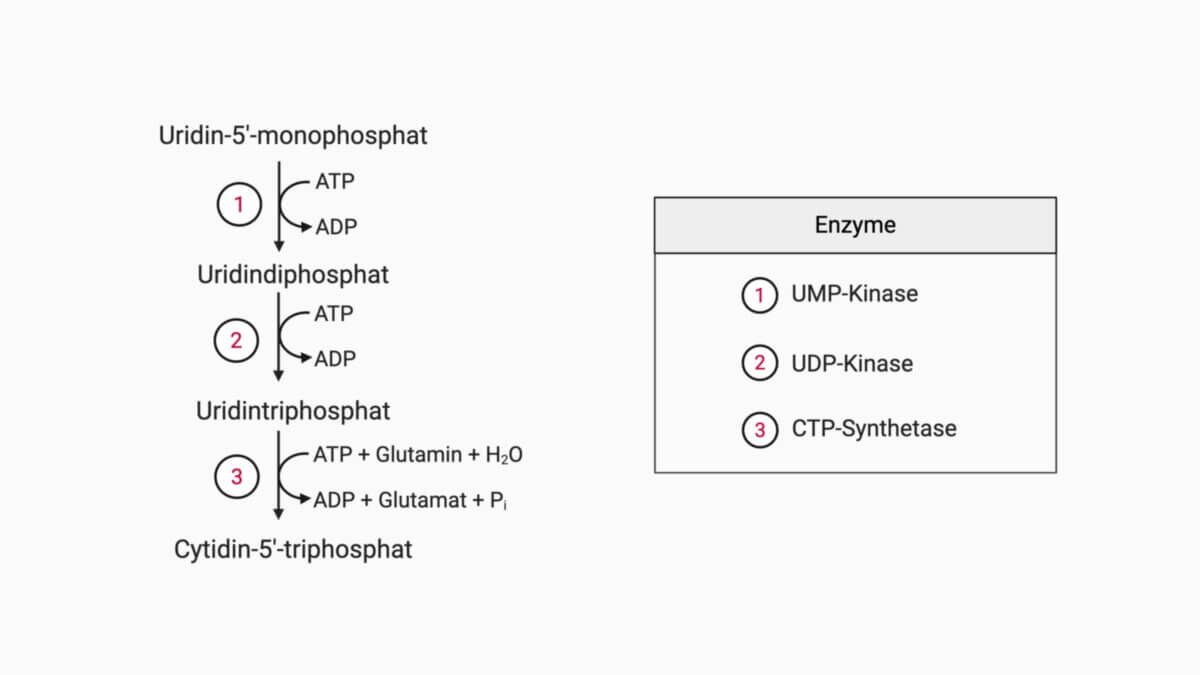
Schließlich katalysiert die Orotidylat-Decarboxylase die Abspaltung von CO₂ und bildet so das Endprodukt UMP. Aus UMP können durch weitere Phosphorylierungen die aktiven Pyrimidinnukleotide UDP und UTP entstehen, die für zahlreiche zelluläre Prozesse benötigt werden.
Cytidin-5'-triphosphat (CTP) entsteht letztlich durch Aminierung aus UTP: Das in der 4. Position angebrachte Sauerstoffatom (O4) wird unter dem Verbrauch von ATP zu einem reaktiven Zwischenprodukt phosphoryliert. Anschließend wird die Phosphatgruppe durch Ammoniak ersetzt, das vorab hydrolytisch aus Glutamin freigesetzt wurde.
Die CTP-Synthetase wird einerseits durch CTP gehemmt, andererseits durch GTP allosterisch aktiviert. Diese Aktivierung ist maßgeblich dafür verantwortlich, dass ein ausgewogenes Verhältnis zwischen Pyrimidinen und Purinen vorliegt.
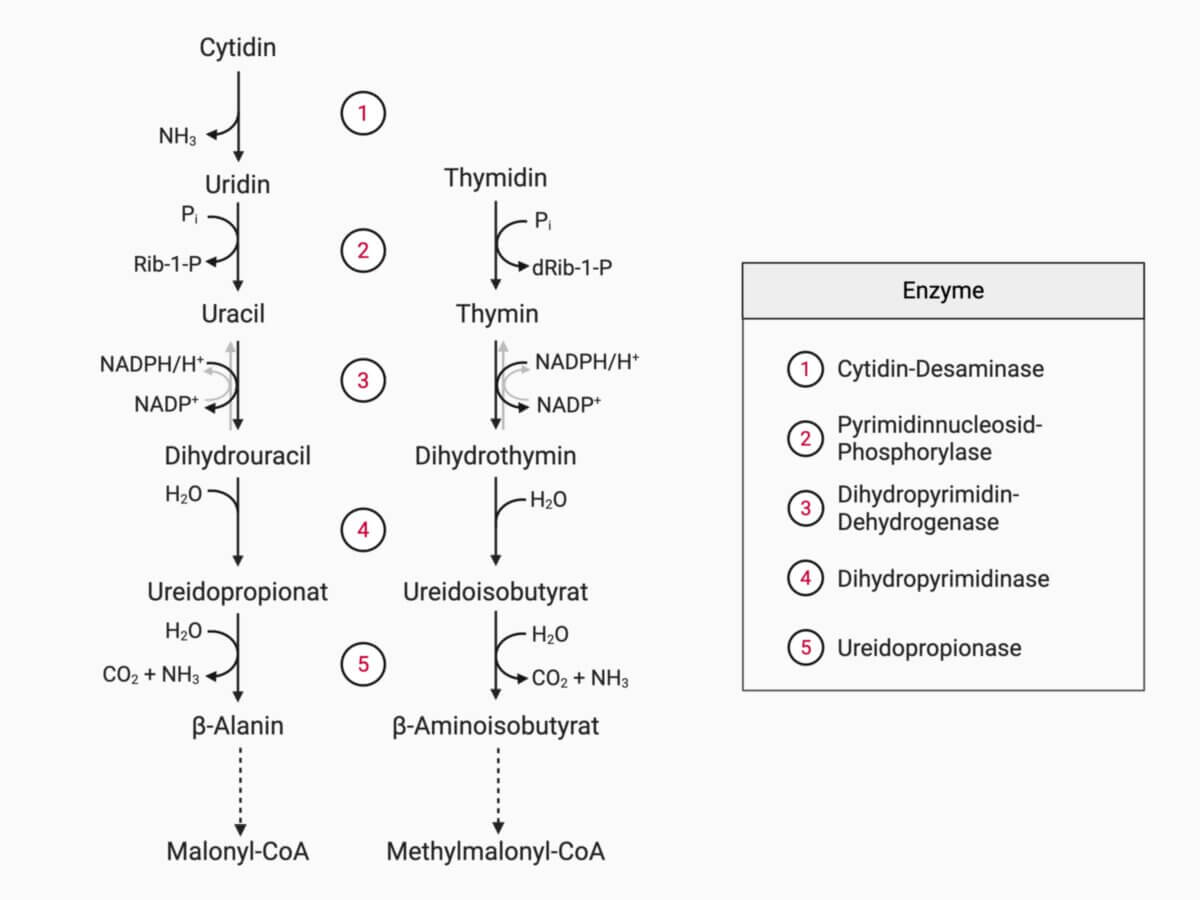
Pyrimidinnukleotidabbau
Anders als beim Purinabbau führt der Abbau der Pyrimidinnukleotide zu Produkten, die der menschliche Organismus leichter verwerten kann. Aus den Pyrimidinnukleotiden CMP, UMP und dTMP entstehen zunächst durch Desaminierung (z.B. Cytidin → Uridin, Enzym: Cytidin-Desaminase) sowie durch Dephosphorylierung die jeweiligen Nukleoside. Es folgt eine phosphorolytische Spaltung der glykosidischen Bindung (Enzym: Pyrimidinnukleosid-Phosphorylase), wobei die freien Basen Uracil und Thymin entstehen.
Diese Basen werden im nächsten Schritt durch die Dihydropyrimidin-Dehydrogenase unter Verbrauch von NADPH zu Dihydrouracil bzw. Dihydrothymin reduziert. Anschließend erfolgt durch die Dihydropyrimidinase die hydrolytische Ringspaltung zu Ureidopropionat (aus Uracil) bzw. Ureidoisobutyrat (aus Thymin). Diese Zwischenprodukte werden schließlich durch das Enzym Ureidopropionase unter Abspaltung von CO₂ und NH₃ in die Endprodukte β-Alanin (aus Uracil) und β-Aminoisobutyrat (aus Thymin) überführt.
Diese Abbauprodukte können weiterverwertet werden: β-Alanin wird zu Malonyl-CoA, β-Aminoisobutyrat zu Methylmalonyl-CoA umgewandelt.
Literatur
- "Duale Reihe Biochemie" - Joachim Rassow et. al., Thieme-Verlag, 3. Auflage
- Heinrich et al. Löffler/ Petrides Biochemie und Pathobiochemie. 9. Auflage. Springer. 2014