Remimazolam
Handelsname: Byfavo®
Englisch: remimazolam
Definition
Remimazolam ist ein Arzneistoff aus der Gruppe der Benzodiazepinderivate, der zur Sedierung, Narkoseeinleitung und Narkoseaufrechterhaltung verwendet wird.
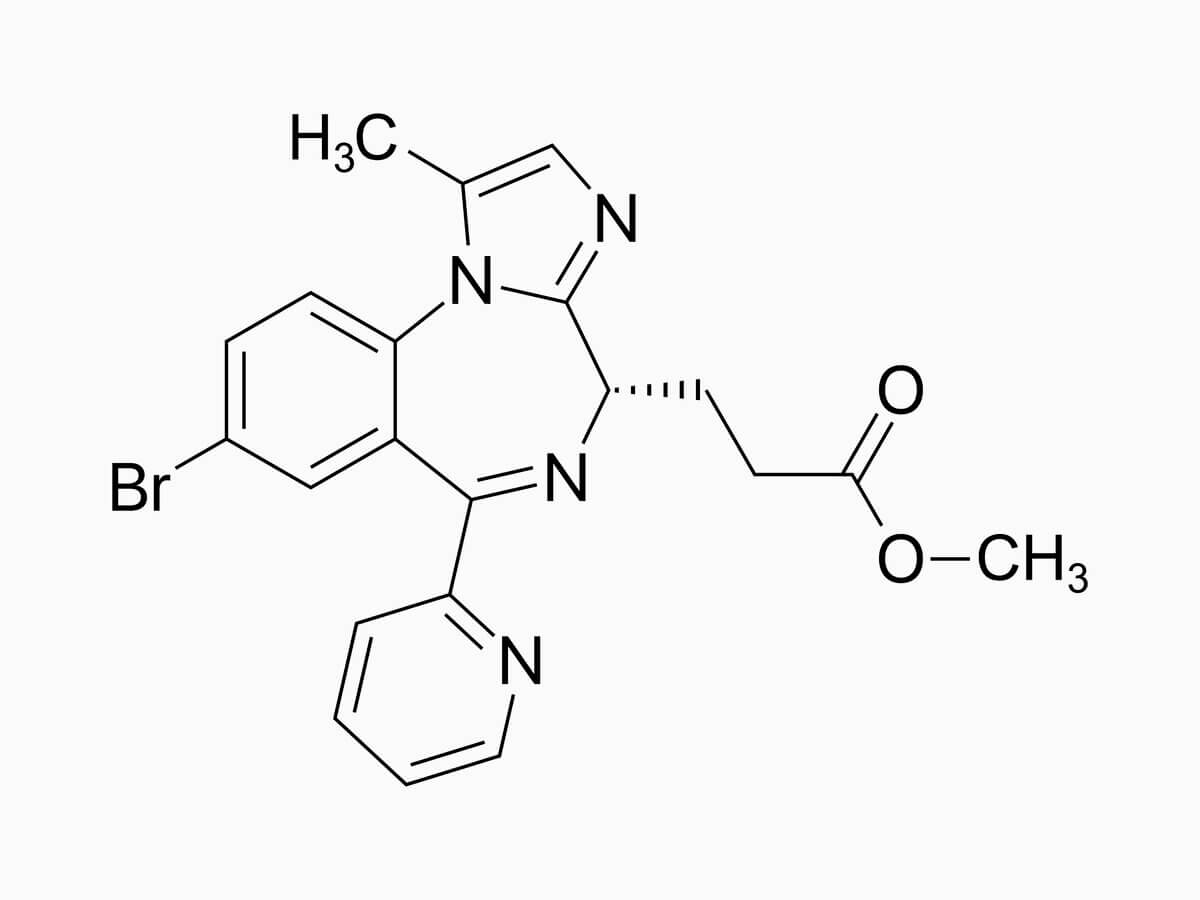
Chemie
Die Summenformel von Remimazolam lautet C21H19BrN4O2. Die molekulare Masse beträgt 439,3 g·mol−1.
Wirkmechanismus
Remimazolam bindet im Gehirn an GABA-A-Rezeptoren und dämpft dadurch die zentralnervöse Aktivität. Es führt so dosisabhängig zu Sedierung, Anxiolyse, Amnesie und Narkose. Remimazolam hat keine analgetische Wirkung.
Pharmakokinetik
Remimazolam verteilt sich nach der i.v.-Injektion rasch im Körper. Die Distributionshalbwertzeit (t1/2α) liegt zwischen 0,5 and 2 Minuten. Die Eliminationshalbwertzeit wurde mit 37 bis 53 Minuten bestimmt. Sie ist bei Patienten mit schweren Leberfunktionsstörungen verlängert. Die Clearance ist nicht abhängig vom Körpergewicht. 50 bis 80% der verabreichten Dosis wird in Form inaktiver Metabolite mit dem Urin ausgeschieden.
Remimazolam wird rasch durch Gewebe-Esterasen zu einem pharmakologisch nahezu inaktiven Metaboliten hydrolysiert. Die kontextsensitive Halbwertszeit ist kurz und weitgehend unabhängig von der Infusionsdauer. Eine relevante Akkumulation ist auch bei längerer Anwendung nicht zu erwarten.
Darreichungsform
Remimazolam ist in der EU in zwei Stärken verfügbar:
- Injektionsflasche mit Trockensubstanz (27,2 mg Remimazolambesylat als lyophilisiertes Pulver), entsprechend 20 mg Remimazolam. Die Trockensubstanz wird mit 8,2 ml steriler Kochsalzlösung versetzt, so dass sich in der gebrauchsfertigen Injektionslösung 2,5 mg/ml Remimazolam befinden.
- Injektionsflasche mit Trockensubstanz entsprechend 50 mg Remimazolam. Das Konzentrat muss vor Anwendung verdünnt werden, um eine Endkonzentration von 1–2 mg/ml zu erreichen (u.a. zur Minimierung lokaler Gefäßirritationen bei höheren Konzentrationen).
Remimazolam 50 mg unterliegt dem Betäubungsmittelgesetz (BtMG). Es ist inkompatibel mit Ringer-Lactat-Infusionslösung.
Indikation
Remimazolam 20 mg ist zugelassen zur Induktion und Aufrechterhaltung einer Sedierung bei Erwachsenen, die sich einer medizinischen Prozedur (z.B. Endoskopie) unterziehen. Remimazolam 50 mg ist zugelassen zur Induktion und Aufrechterhaltung einer Allgemeinanästhesie bei Erwachsenen.
Der Wirkstoff wird zudem zur Anwendung im Rahmen einer Analgosedierung in der Intensivmedizin verwendet (Off-Label-Use).
Dosierung
Die Dosierung erfolgt titrationsgesteuert und richtet sich nach gewünschter Sedierungstiefe/Narkosetiefe, Alter, ASA-Status, Körpergewicht sowie Begleitmedikation (v.a. Opioide). Zwischen zusätzlichen Bolusgaben sollen mindestens 2 Minuten liegen, um die volle Wirkung beurteilen zu können.[1]
Prozedurale Sedierung (Remimazolam 20 mg)
Die Fachinformation unterscheidet praxisnah zwischen Anwendung '''mit''' oder '''ohne Opioid''' und zwischen Erwachsenen < 65 Jahre vs. ältere/gebrechliche Patienten (≥ 65 Jahre und/oder ASA III–IV und/oder < 50 kg).
- mit Opioid und < 65 Jahre: initial 5 mg i.v. über 1 Minute, danach bei Bedarf 2,5 mg i.v. über 15 s zur Erhaltung/Titration
- mit Opioid und ≥ 65 Jahre und/oder ASA III–IV und/oder < 50 kg: initial 2,5–5 mg i.v. über 1 Minute, danach bei Bedarf 1,25–2,5 mg i.v. über 15 s
- ohne Opioid und < 65 Jahre: initial 7 mg i.v. über 1 Minute, danach bei Bedarf 2,5 mg i.v. über 15 s
- ohne Opioid und ≥ 65 Jahre und/oder ASA III–IV und/oder < 50 kg: Initial 2,5–5 mg i.v. über 1 Minute, danach bei Bedarf 1,25–2,5 mg i.v. über 15 s
Wenn mit 5 Dosen innerhalb von 15 Minuten keine ausreichende Sedierung erreicht wird, soll die zusätzliche oder alleinige Gabe eines anderen Sedativums erwogen werden.
Allgemeinanästhesie (Remimazolam 50 mg)
- Einleitung: Remimazolam als i.v.-Infusion mit 6 mg/min, titriert nach klinischer Reaktion; bei Bedarf Steigerung bis maximal 12 mg/min. Die meisten Erwachsenen benötigen etwa 10–40 mg
- Aufrechterhaltung: kontinuierliche i.v.-Infusion; empfohlener Start 1 mg/min mit einem Bereich von 0,1–2,5 mg/min (klinisch titriert). Zusätzlich können während laufender Infusion bei Bedarf Bolusgaben von 6 mg über 1 Minute verabreicht werden; innerhalb von 60 Minuten maximal 3 Boli im Abstand von mindestens 5 Minuten. Gegen Ende der Operation (z.B. 15 Minuten vor Ende) kann die Dosis heruntertitriert werden, um ein schnelleres Erwachen zu ermöglichen.
- Besondere Patientengruppen (Auswahl): Bei älteren Patienten/ASA III–IV/< 50 kg sollte die Anfangsdosis im unteren Bereich gewählt werden. Bei Niereninsuffizienz ist laut Fachinformation keine Dosisanpassung erforderlich. Bei schwerer Leberinsuffizienz können Wirkung und Erholungszeit verlängert sein; es wird keine feste Anpassung vorgegeben, jedoch erhöhte Vorsicht bei der Titration empfohlen.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Wechselwirkungen
Die Sedierung unter Remimazolam wird durch gleichzeitige Gabe von Opioidanalgetika, Benzodiazepinen oder Propofol verstärkt, so dass ein kontinuierliches Monitoring der Vitalparameter und eine Dosistitration erforderlich sind.
Kontraindikationen
- Überempfindlichkeit gegenüber Dextran 40
- instabile Myasthenia gravis
Zulassung
Remimazolam wurde im Juli 2020 in den USA von der FDA zugelassen. Der Wirkstoff wird von Paion in Zusammenarbeit mit Ono Pharmaceutical vermarktet. 2021 wurde Remimazolam in der EU zugelassen. Die Marteinführung in Deutschland erfolgte im Januar 2026.
Literatur
- Yamaguchi S et al. Remimazolam for simultaneous percutaneous mitral valve clip and percutaneous left atrial appendage closure in an elderly patient with impaired cardiac function: A case report. Clin Case Rep. 2024 - Fallbericht
- Siebenand: Ein neues Benzodiazepin im Handel. Pharmazeutische Zeitung, 02.01.2026
- Gelbe Liste: Neueinführung Byfavo: Neues Benzodiazepin zur prozeduralen Sedierung, zuletzt abgerufen am 08.01.2026