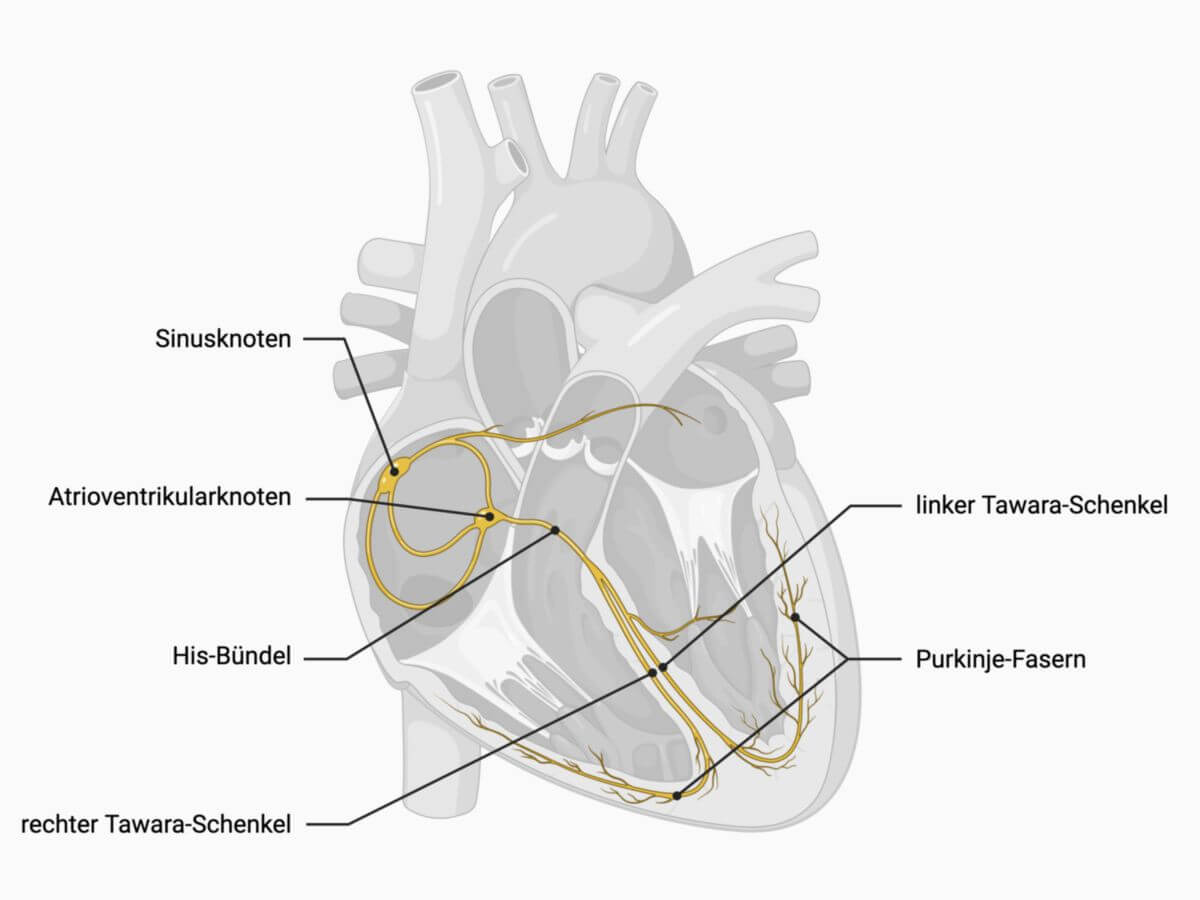
Sinusknoten
Synonyme: Nodus sinuatrialis, Keith-Flack-Knoten, Sinuatrial-Knoten, SA-Knoten
Englisch: sinus node, sinoatrial node, Keith and Flack node
Definition
Der Sinusknoten ist das primäre Schrittmacherzentrum des Herzens und an der komplexen Regulation der Herzfrequenz beteiligt. Er spielt eine zentrale Rolle bei der Erregungsbildung.
Anatomie
Der Sinusknoten ist eine muskuläre, makroskopisch schlecht abgrenzbare, etwa 3 mm dicke und 10 mm lange Struktur von kommaförmiger Gestalt. Er liegt subepikardial im Sulcus terminalis auf der Dorsalseite des rechten Herzvorhofs und kaudal der Einmündung der Vena cava superior. Gelegentlich reicht er bis in das rechte Herzohr.
Vom Sinusknoten abgehend werden mitunter drei Faserbündel (Internodalbündel) beschrieben, die in Richtung des Atrioventrikularknotens ziehen:
- vorderes Internodalbündel (Bachmann-James-Bündel)
- mittleres Internodalbündel (Wenckebach-Bündel)
- hinteres Internodalbündel (Thorel-Bündel)
Vom vorderen Internodalbündel zweigt das interatriale Bündel (Bachmann-Bündel) ab, das zum linken Vorhof zieht.
Die Existenz der Internodalbündel ist umstritten, da sie sich nach strengen histologischen Kriterien nicht klar abgrenzen lassen.[1]
Die Durchblutung des Sinusknotens erfolgt durch den Ramus nodi sinuatrialis, der meist aus der Arteria coronaria dextra, in 30 % der Fälle aus der Arteria coronaria sinistra entspringt. Der Sinusknoten wird von Sympathikus und Parasympathikus (Nervus vagus) angesteuert, die damit in die komplexe Regulation des Herzrhythmus eingreifen.
Histologie
Der Sinusknoten wird von spezifischen Herzmuskelzellen gebildet. Man unterscheidet dabei P-Zellen und Transitionszellen:
- P-Zellen ("pacemaker") sind rundliche, blasse Zellen, die bevorzugt in Gruppen liegen und über Nexus (Connexine 45 und 40) und Desmosomen verbunden sind. Sie enthalten weder typische Glanzstreifen, noch transversale Tubuli oder eine Basallamina. Außerdem besitzen sie nur wenige Myofibrillen und Mitochondrien.
- Transitionszellen sind elongierte, zum Teil verzweigte Kardiomyozyten, die viele Myofibrillen enthalten und P-Zellgruppen untereinander und mit dem Arbeitsmyokard verbinden.
Physiologie
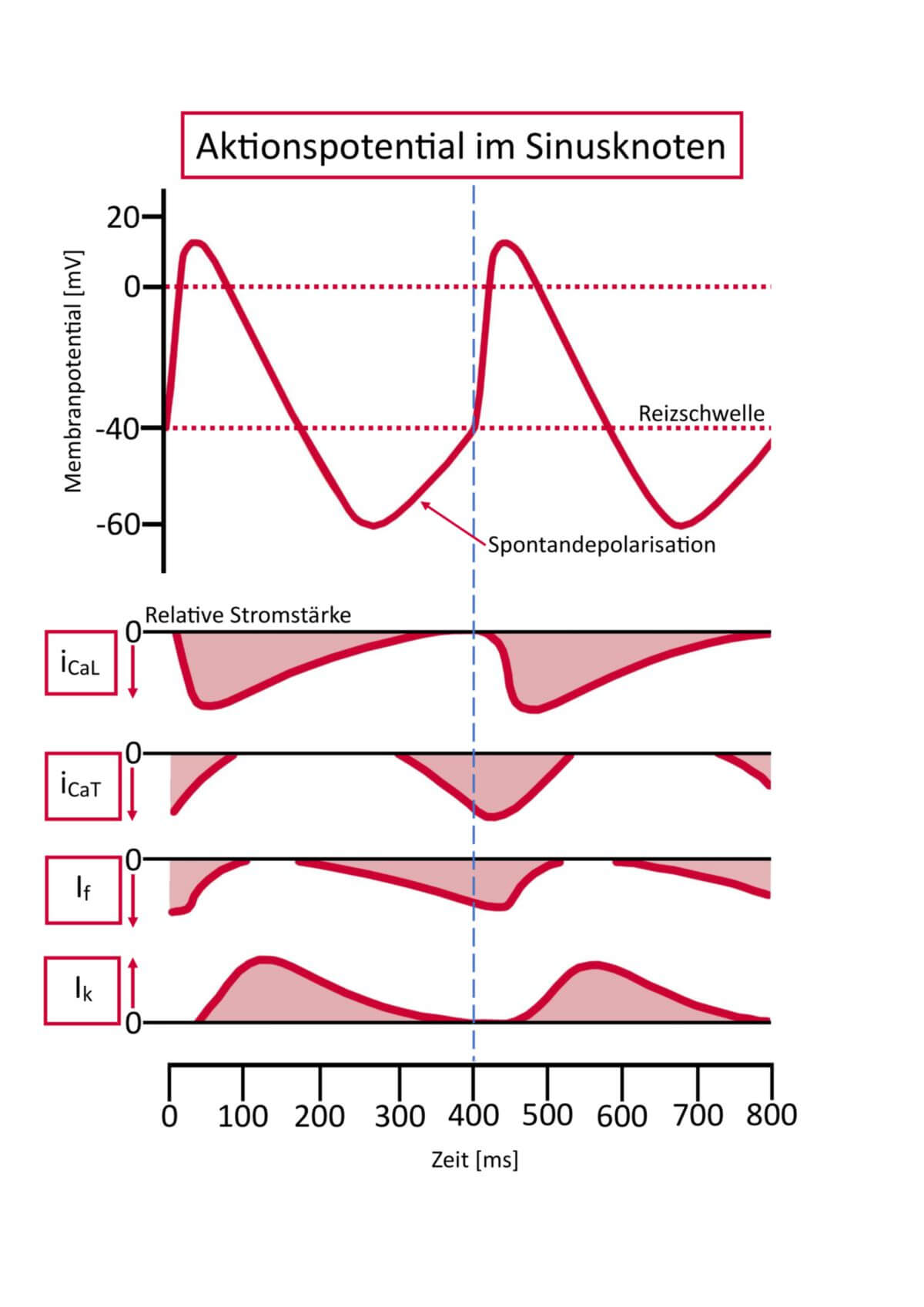
Die P-Zellen des Sinusknotens besitzen mit ungefähr -60 mV ein höheres Membranpotenzial als das Arbeitsmyokard (-90 mV). Dabei führt ein durch Hyperpolarisation geöffneter Kationenkanal (HCN-Kanal) über einen Natriumeinstrom zu einer langsamen Depolarisation. Dieser Kationenstrom wird auch als "I-funny" bezeichnet.
Nach Erreichen eines Schwellenwertes öffnen sich spannungsabhängige Calciumkanäle vom T-Typ. Der folgende Calciumeinstrom bewirkt die Öffnung von spannungsabhängigen Calciumkanälen vom L-Typ und eine schnelle Depolarisation auf ungefähr +20 mV.
Das Membranpotenzial der P-Zellen wird insbesondere durch Kaliumkanäle reguliert, die durch M2-Acetylcholinrezeptoren gesteuert werden. Dabei bewirkt das aus parasympathischen Nervenfasern freigesetzte Acetylcholin eine Öffnung dieser Kaliumkanäle. Das erhöht das Membranpotenzial und verlangsamt die Herzfrequenz.
Üblicherweise depolarisieren die Sinusknotenzellen spontan etwa einmal pro Sekunde und leiten ihre elektrische Erregung auf das Arbeitsmyokard der sie umgebenden Vorhöfe weiter; damit leiten sie die Herzkontraktion ein und bestimmen – von Sympathikus beziehungsweise Parasympathikus beeinflusst – den Herzrhythmus.
Die vom Sinusknoten ausgehenden Aktionspotenziale werden innerhalb von 40 bis 80 ms zum AV-Knoten weitergeleitet. Eine besonders schnelle Erregungsleitung erfolgt über die Crista terminalis.
Pathophysiologie
Wenn die spontane Reizbildung des Sinusknotens ausfällt, spricht man von einem Sinusarrest. Er kann zum Beispiel im Rahmen eines Sick-Sinus-Syndroms auftreten. In diesem Fall kann der Atrioventrikularknoten die Funktion als primärer Rhythmusgeber aufnehmen und eine Herzfrequenz von 40 bis 60 Schlägen pro Minute steuern.
Unter bestimmten Bedingungen (beispielsweise bei koronarer Herzerkrankung) depolarisiert der Sinusknoten zu langsam, eine Sinusbradykardie ist dann die Folge.
Podcast

Quelle
- ↑ Sternick et al. Critical Assessment of the Concepts and Misconceptions of the Cardiac Conduction System over the Last 100 Years: The Personal Quest of Robert H. Anderson. Journal of Cardiovascular Development and Disease, Januar 2021
Bildquelle
- Bildquelle Podcast: © Jeff W / Unplash