Ras
Synonyme: Rat sarcoma, G-Protein Ras, Ras-Protein, Ras-GTPase
Englisch: p21/Ras protein
Definition
Ras bezeichnet eine Familie von Protoonkogenen, die kleine monomere G-Proteine kodieren, sogenannte Ras-Proteine. Sie zählen zur Ras-Superfamilie.
Nomenklatur
Biochemie
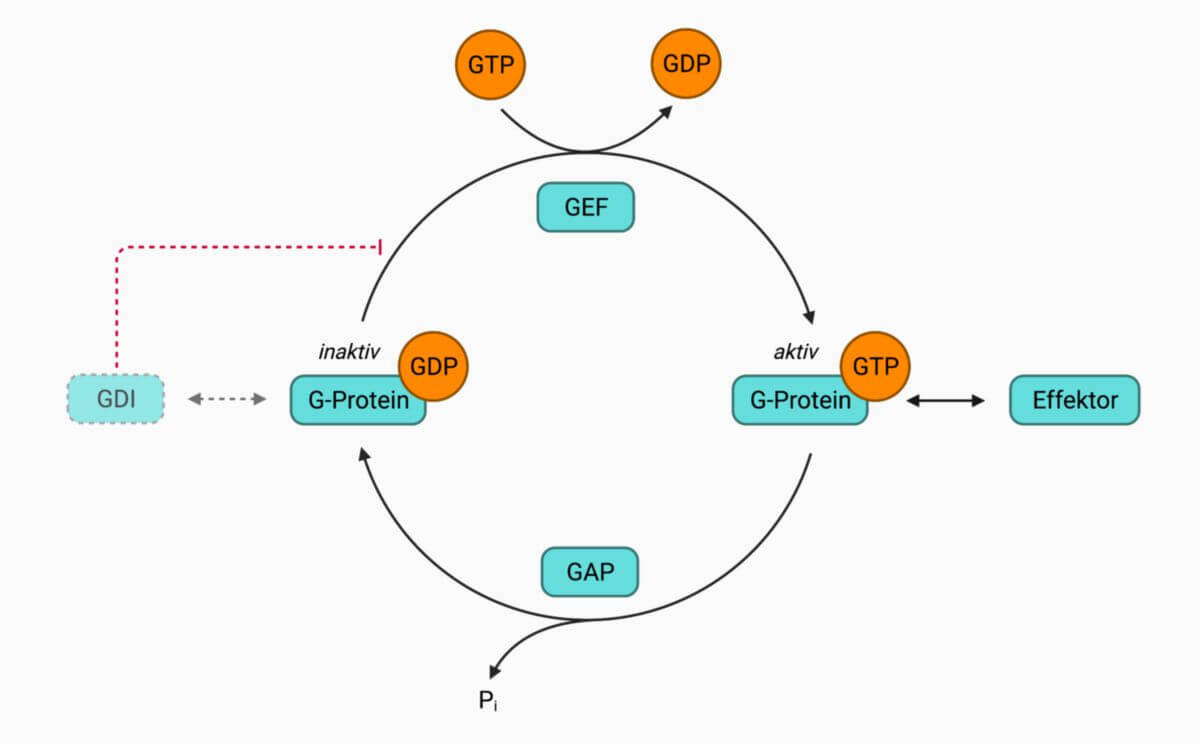
Ras-Proteine binden GTP und GDP. Die GTP-gebundene Form stellt den aktiven Zustand dar. Durch intrinsische GTPase-Aktivität, die durch GTPase-aktivierende Proteine (Ras-GAPs) verstärkt wird, kann GTP zu GDP hydrolysiert und Ras somit inaktiviert werden. Guaninnukleotid-Austauschfaktoren (Ras-GEFs) vermitteln dann den Austausch von GDP zu GTP und starten den Zyklus somit von neuem.
Ras-Proteine werden über einen Farnesylrest in der Membran verankert. Die Modifikation erfolgt durch Farnesyltransferasen innerhalb einer Konsensussequenz am C-Terminus, der CaaX-Box. CaaX ist durch eine Aminosäurenabfolge aus Cystein, gefolgt von zwei aliphatischen und einer variablen Aminosäure charakterisiert.
Funktion
Ras-Proteine sind Knotenpunkte verschiedener Signalwege und werden durch externe Stimuli aktiviert. Durch die Interaktion mit diversen Effektorproteinen steuern sie u.a. die Genexpression und regulieren die Proliferation, Zelldifferenzierung und das Überleben der Zelle. Über den GTP/GDP-Zyklus wirken Ras-Proteine als molekulare Schalter und steuern die Dauer von zellulären Prozessen. Am Besten beschrieben ist die Funktion von Ras als Bestandteil des Ras/Raf/MAPK-Signalwegs.
Ras/Raf/MAPK-Signalweg
Nach Aktivierung des EGF-Rezeptors durch seine Liganden bindet er das Adapterprotein Grb2, das wiederum über eine SH3-Domäne mit dem Ras-GEF SOS interagiert. Der nun entstandene Grb2-SOS-Komplex wird vom Rezeptor als "verlängerter Arm" genutzt, um das inaktive Ras-GDP in das aktive Ras-GTP umzuwandeln. Ras-GTP rekrutiert die zytosolische Serin/Threonin-Kinase Raf zur Zellmembran und aktiviert sie somit. Raf wiederum phosphoryliert eine weitere Kinase: MEK (MAP/Erk-Kinase). Darüber wird eine Phosphorylierungskaskade in Gang gesetzt, die das Signal in der Zelle amplifiziert.
Pathobiochemie
Da es sich bei Ras um ein Protoonkogen handelt, können Punktmutationen karzinogen wirken. Häufig sind dabei die Codons betroffen, die für die Glycine an Position 12 und 13 kodieren (G12 und G13). Dadurch verliert das Ras-Protein seine GTPase-Aktivität und bleibt somit dauerhaft aktiv. Nach Aktivierung durch Wachstumsfaktoren wie PDGF oder EGF überführt Ras den Zellzyklus in die S-Phase und leitet damit die Zellteilung ein. Die dauerhaft aktiven Ras-Proteine akkumulieren und bewirken eine ständige Stimulation des Zellwachstums.
20 bis 30 % aller humanen Tumoren weisen Ras-Mutationen auf. Die Detektion der Ras-Mutationen durch DNA-Sequenzierung ist klinisch relevant, da häufig gängige Therapien, die sich gegen der EGF-Rezeptor richten, nicht anschlagen.
Quellen
- Takai et al. Small GTP-binding proteins Physiol Rev 2001
- Wennerberg et al. Ras superfamily at a glance J Cell Sci 2005