Extrakorporale Membranoxygenierung
Synonyme: extrakorporale Lungenunterstützung, ECMO, ECLA
Englisch: extracorporeal membrane oxygenation, extracorporeal life support, ECLS
Definition
Die Extrakorporale Membranoxygenierung, kurz ECMO, ist eine technische Methode, das Blut eines Patienten mit einer Lungenkrankheit und/oder einem Lungenversagen (z.B. ARDS) oder bei kardialem Versagen mittels einer externen Maschine künstlich zu oxygenieren.
Hintergrund
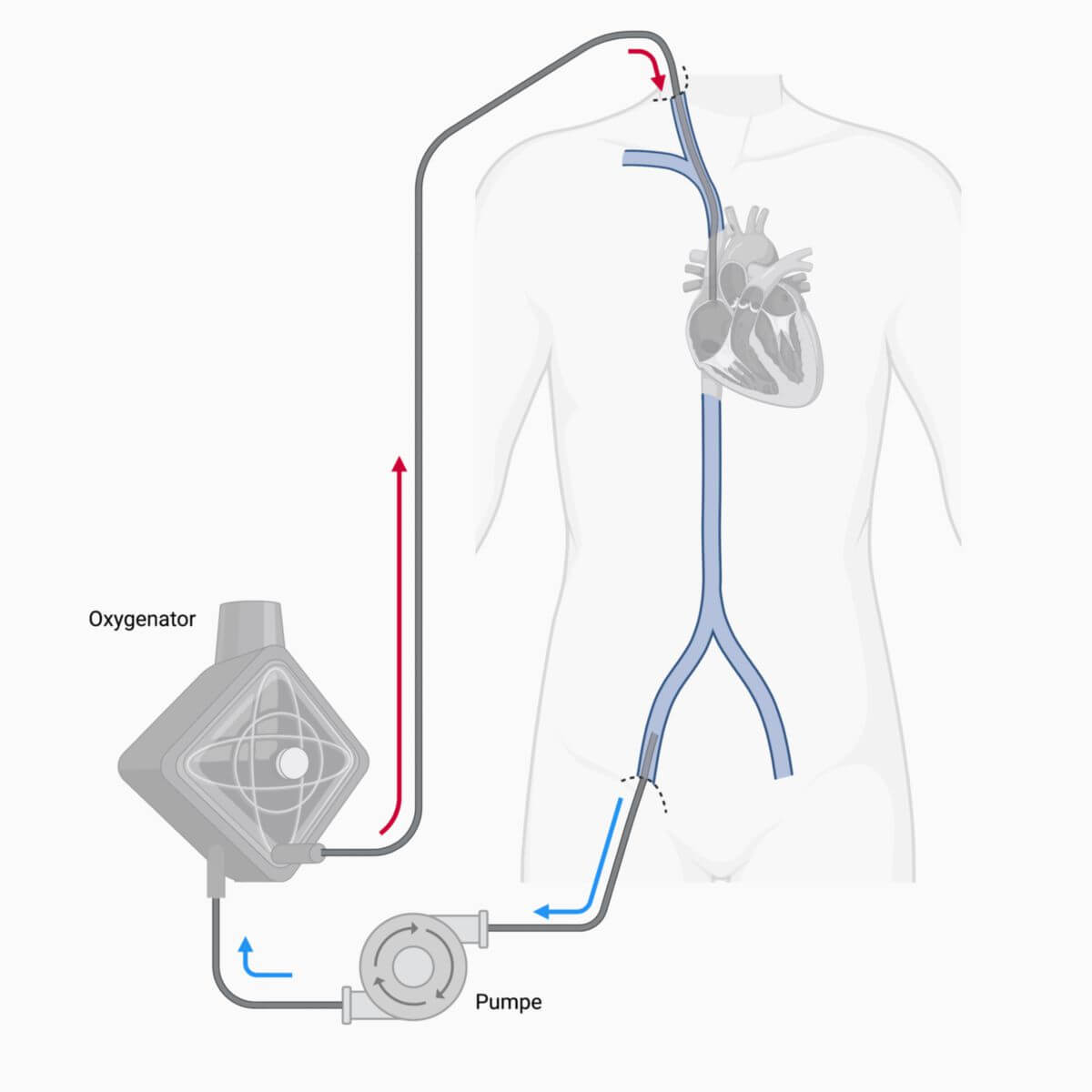
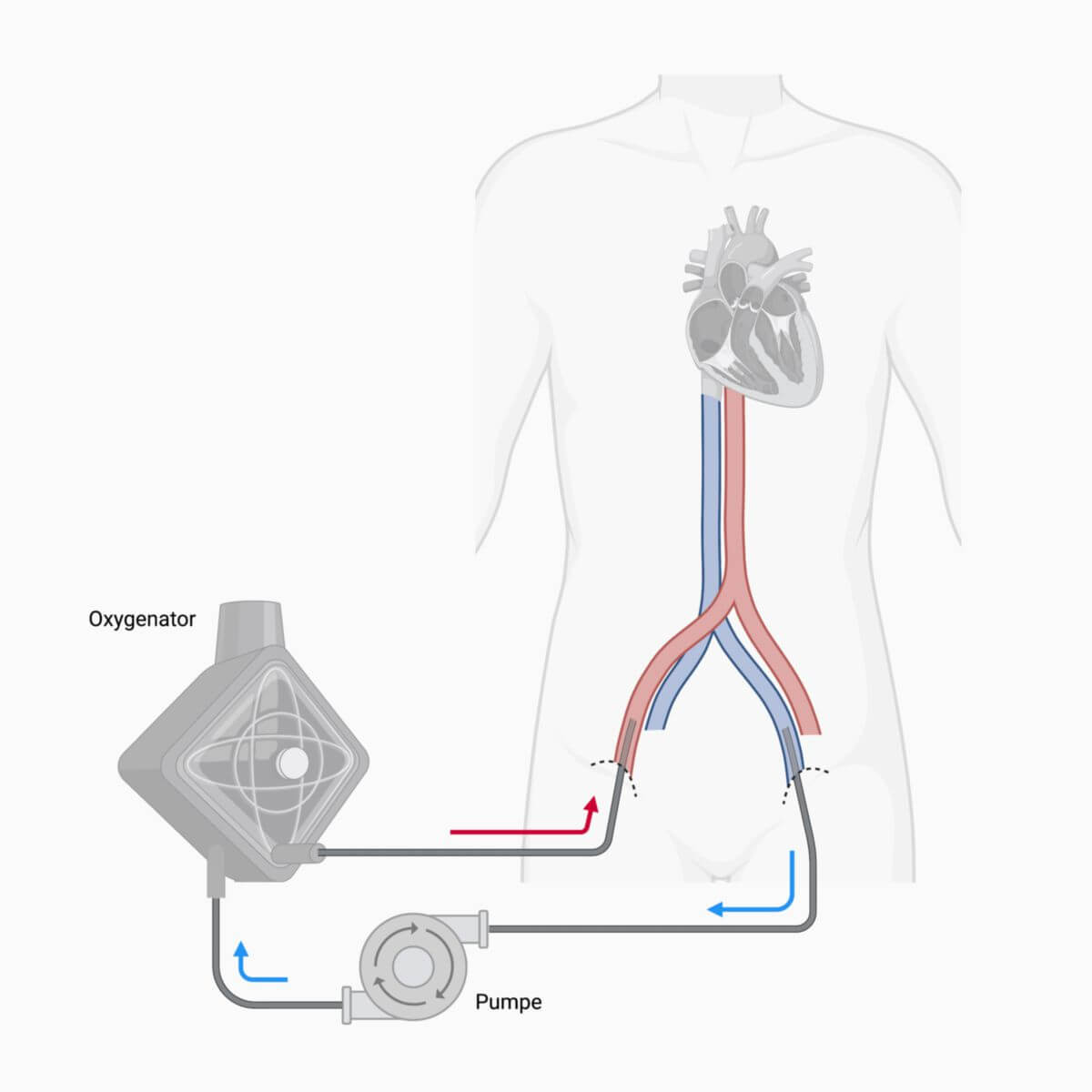
In der Regel wird Blut aus dem venösen System ausgeleitet, über Membranen oxygeniert und decarboxyliert und letztendlich wieder in den Körper zurückgeleitet. Je nach Indikation erfolgt die Rückleitung venös oder arteriell.
Geschichte
Der erste Einsatz der ECMO erfolgte in den 1970er Jahren in den USA. Indikation hierzu war das ARDS. Nach zunächst erfolglosen Studien konnte letztendlich doch ein Benefit der ECMO nachgewiesen werden. Die ersten erfolgreichen Anwendungen in Deutschland wurden bei akutem Lungenversagen des Erwachsenen in den Jahren 1971 und 1983 an der Universität Düsseldorf, sowie bei Verbrennungen erstmals 1975 an der Klinik für Anästhesiologie der Universität Bonn durchgeführt. Im Februar 1987 wurde in der Mannheimer Kinderklinik die erste erfolgreiche ECMO-Anwendung bei einem Neugeborenen im deutschsprachigen Raum durchgeführt.
Indikation
Die Hauptindikation der ECMO ist schweres Lungenversagen, wie beim Atemnotsyndrom des Neugeborenen bzw. dem Acute Respiratory Distress Syndrome beim Erwachsenen. Zudem wird sie unter anderem bei Mekoniumaspiration oder bei persistierender pulmonaler Hypertonie angewendet.
Ein wichtiges Einsatzgebiet ist das ARDS bei COVID-19-Pneumonie.
Inzwischen wird die ECMO zunehmend auch bei Patienten im kardiogenen Schock oder bei anhaltendem Herz-Kreislauf-Stillstand eingesetzt.
Maschine
Die ECMO-Maschine ist im Prinzip wie eine Herz-Lungen-Maschine aufgebaut. Sie besteht aus einer Blutpumpe, einem Oxygenator, einer Gasblende, einem Wärmeaustauscher, einem Druckmodul sowie einer sogenannten Bladder-Box.
Vorgehen
Der Abfluss des Blutes erfolgt über eine venöse Kanüle. In der sogenannten Bladder-Box erfolgt die Antikoagulation, meistens durch Beimengung von Heparin aus einem Perfusor. Dies verhindert eine Koagulation des Blutes in den Schläuchen und Kompartimenten der Maschine und bewahrt den Patienten vor lebensgefährlichen thrombembolischen Ereignissen. Anschließend wird dem Blut im Oxygenator das Kohlendioxid entzogen und Sauerstoff zugeführt. Dies entspricht dem Vorgang der Oxygenierung. Im weiteren Verlauf wird das Blut, je nach Bedarf, im Wärmeaustauscher erwärmt oder gekühlt.
Je nach Indikation wird das Blut dann über eine Vene (bei primär pulmonaler Indikation) oder über eine Arterie (bei primär kardialer Indikation) wieder in den Körper zurückgeleitet.
Varianten
In den meisten Fällen werden im Rahmen einer ECMO zwei Kanülen verwendet – eine zur Drainage und eine zur Rückleitung des Blutes. Unter bestimmten Umständen kann es notwendig sein, ein bereits angelegtes VA- oder VV-ECMO-System um eine dritte Kanüle zu ergänzen. Folgende Varianten sind möglich:
| Variante | Bezeichnung | Blutentnahme über... | Rückleitung über... | Indikation |
|---|---|---|---|---|
Zweifachkanülierung | ||||
| Venovenös | VV-ECMO[1] | Großlumige Vene (Vena femoralis) | Großlumige Vene (rechter Vorhof, Vena jugularis oder Vena subclavia) | Zum Gasaustausch, v.a. bei respiratorischem Versagen |
| Venoarteriell | VA-ECMO[1] (= ECLS) | Großlumige Vene (Vena femoralis) | Großlumige Arterie (Arteria femoralis) | Zur hämodynamischen Unterstützung, v.a. bei kardialem Versagen |
| Linker Vorhof | Aorta ascendens | Speziell bei linksventrikulärem Versagen | ||
| Rechter Vorhof | Speziell bei rechtsventrikulärem Versagen | |||
| Arteriovenös | AV-ECMO | Arteria femoralis | Vena femoralis | Wird zur ultraprotektiven Beatmung eingesetzt, da auf diese Weise das CO2 nur durch den eigenen Blutfluss des Patienten ausgewaschen werden kann. |
Dreifachkanülierung | ||||
| Veno-venoarteriell | VVA-ECMO | Erster Abfluss über großlumige Vene (Vena subclavia oder Vena jugularis interna) | Großlumige Arterie (Arteria femoralis) | Erweiterung der VA-ECMO: Bei unzureichender venöser Drainierung unter der VA-ECMO, die in einem unzureichenden Fluss in der ECMO resultiert. |
| Zweiter Abfluss über Vena femoralis | ||||
| Veno-arterio-venös | VAV-ECMO | Großlumige Vene (Vena femoralis) | Erster Zufluss über großlumige Arterie (Arteria femoralis) | Zeitgleiches Herz- und Lungenversagen, z.B. bei:
|
| Zweiter Zufluss über Vena cava superior, in Richtung des rechten Vorhofs | ||||
| Veno-arterio-pulmonalarteriell | VAPa-ECMO | Großlumige Vene (Vena cava superior oder Vena cava inferior) | Erster Zufluss über großlumige Arterie (Arteria femoralis) | Zur Überbrückung des rechten Herzens, z.B. bei:
Bisher ist diese Form der ECMO noch nicht in Studien validiert. (2023) |
| Zweiter Zufluss über Arteria pulmonalis | ||||
Komplikationen
Zu den möglichen Komplikationen der ECMO zählen:[2][3]
| Direkte Komplikationen | |
| Gerinnselbildung im ECMO-System | 17,8 |
| Versagen des Membranoxygenators | 17,5 |
| Kanülenprobleme (Dislokation etc.) | 8,4 |
| Sonstige | 7,9 |
| Indirekte Komplikationen | |
| Nachblutungen | 19 |
| Blutungen im Bereich der Kanülierungsstelle(n) | 17,1 |
| Pulmonale Blutung | 8,1 |
| Gastrointestinale Komplikationen (Blutungen, NOMI) | 5,1 |
| Intrakranielle Blutung | 3,8 |
| Hämolyse | 6,9 |
| Disseminierte intravasale Gerinnungsstörung | 3,7 |
Ferner kann es bei der venoarteriellen ECMO zum sogenannten Harlekin-Phänomen kommen.
Literatur
- Pooboni et al., Vascular access in ECMO, Indian journal of thoracic and cardiovascular surgery, 2021
- Bernhardt et al., Extrakorporale Membranoxygenierung, Deutsches Ärzteblatt, 2022
- Napp et al., Triple Cannulation ECMO, Extracorporeal Membrane Oxygenation – Advances in Therapy, IntechOpen, 2015
Quellen
- ↑ 1,0 1,1 HZD NRW – One Minute Wonder ECMO-Kanülierung, abgerufen am 13.06.2023
- ↑ Pilarczyk K, Trummer G, Jakob HG, Dusse F, Marggraf G. Extrakorporale Herz- und Lungenersatzverfahren: „Extracorporeal membrane oxygenation“, „extracorporeal life support“ und „pumpless extracorporeal lung assist“. Z Herz Thorax Gefasschir. 2013;27(1):37-48. German. doi: 10.1007/s00398-012-0984-9. Epub 2013 Jan 16. PMID: 32288287; PMCID: PMC7102028.
- ↑ Renaudier M, de Roux Q, Bougouin W, Boccara J, Dubost B, Attias A, Fiore A, de'Angelis N, Folliguet T, Mulé S, Amiot A, Langeron O, Mongardon N. Acute mesenteric ischaemia in refractory shock on veno-arterial extracorporeal membrane oxygenation. Eur Heart J Acute Cardiovasc Care. 2020 Jan 1;10(1):62–70. doi: 10.1177/2048872620915655. PMID: 33609105.