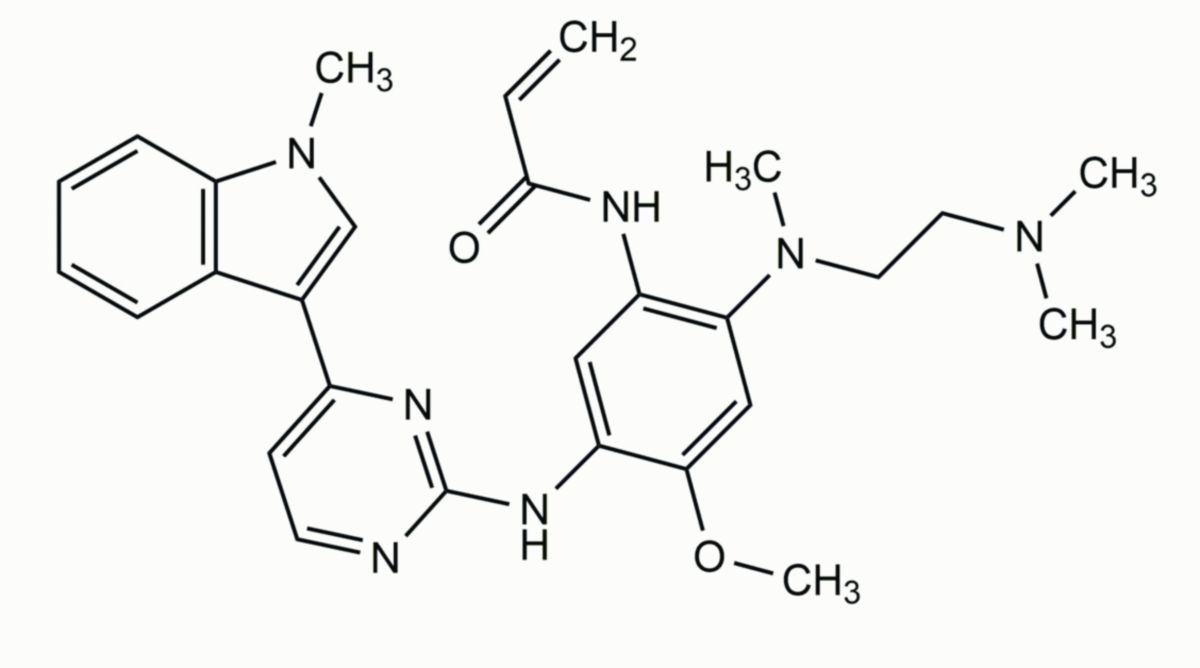
Osimertinib
Handelsname: Tagrisso®
Definition
Osimertinib ist ein Arzneistoff aus der Gruppe der Tyrosinkinase-Inhibitoren. Er wird in der Onkologie unter anderem zur Therapie des nicht-kleinzelligen Bronchialkarzinoms (NSCLC) eingesetzt.[1]
Chemie
Wirkmechanismus
Osimertinib ist ein selektiver Inhibitor des EGF-Rezeptors, genauer seiner Tyrosinkinase-Domäne. Dieser Rezeptor ist normalerweise für das Zellwachstum zuständig, so dass bei dessen Hemmung auch das Tumorzellwachstum unterdrückt wird.
Bei Patienten mit NSCLC und aktivierender Mutation im EGFR ist die Therapie mit einem Tyrosinkinase-Inhibitor (TKI) einer Chemotherapie überlegen. Der Tumor entwickelt allerdings Resistenzmechanismen gegen die TKI, z.B. eine T790M-Mutation. Die T790M-Mutation auf Exon 20 des EGFR-Gens ist die häufigste Resistenzmutation des NSCLC.[2] In diesen Fällen kann die Therapie mit Osimertinib fortgesetzt werden, da der Wirkstoff selektiv und irreversibel an den EGFR mit T790M-Mutation bindet und dessen dauerhafte Aktivierung hemmt.[1][3]
Pharmakokinetik
Der Steady State wird etwa 15 Tage nach oraler Einnahme erreicht. Die Eliminationshalbwertszeit beträgt rund 44 Stunden.[1]
Indikation
- Erstlinientherapie von Erwachsenen mit lokal fortgeschrittenem oder metastasiertem nicht-kleinzelligem Bronchialkarzinom (NSCLC) und nachgewiesener T790M-Mutation im epidermalen-Wachstumsfaktor-Rezeptor (EGFR)[1]
- Erstlinientherapie in Kombination mit Pemetrexed und platinhaltiger Chemotherapie von Erwachsenen mit fortgeschrittenem NSCLC, deren Tumoren EGFR-Mutationen als Deletion im Exon 19 oder Substitutionsmutation im Exon 21 (L858R) aufweisen.[4]
Dosierung
Die empfohlene Dosis Osimertinib beträgt 80 mg einmal täglich. Schwere Nebenwirkungen können eine Dosisreduktion auf 40 mg täglich notwendig machen.[1]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Folgende Nebenwirkungen treten unter Osimertinib sehr häufig (≥1:10) auf:[1]
- Blut: Thrombozytopenie, Lymphopenie, Neutropenie, Leukopenie
- Haut: Pruritus, Paronychie, Hautausschlag, Trockene Haut
- Endokrines System: Hypothyreose
- Gefäßsystem: Hypertonie, Blutung
- Gastrointestinaltrakt: Diarrhö, Stomatitis
- Harnwege: Proteinurie
- Atemwege: Interstitielle Lungenerkrankung
Weitere wichtige Nebenwirkungen sind Herzrhythmusstörung, Herzklappenerkrankung, Herzinfarkt und Herzinsuffizienz.[5]
Wechselwirkungen
Der Metabolismus von Osimertinib erfolgt hauptsächlich über CYP3A4 und CYP3A5. Die gleichzeitige Einnahme von Johanniskraut und anderen Induktoren dieser Enzyme sollte daher vermieden werden. Die gleichzeitige Einnahme von CYP4A4-Inhibitoren und Protonenpumpenhemmern ist dagegen unproblematisch. Ein Wirkverlust oraler Kontrazeptiva kann nicht ausgeschlossen werden.[1]
Kontraindikationen
- Überempfindlichkeit gegenüber dem Wirkstoff
- Schwangerschaft und Stillzeit[1]
Zulassung
Das Arzneimittel ist in der EU seit 2016 zugelassen und wird durch AstraZeneca vermarktet.[1]
Kosten
Die Jahrestherapiekosten betragen pro Patient rund 98.000 €.[6]
Nutzenbewertung
Der Zusatznutzen einer Therapie mit Osimertinib wird vom G-BA auf der Basis der vom IQWiG ausgewerteten Studienergebnisse wie folgt eingeordnet:[6]
- Anhaltspunkt für einen nicht quantifizierbaren, mindestens beträchtlichen Zusatznutzen von Osimertinib gegenüber einer Vergleichstherapie mit Cisplatin und Pemetrexed
Quellen
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Fachinfo Osimertinib, abgerufen am 04.10.2018
- ↑ Sreenath V. Sharma, Daphne W. Bell, Jeffrey Settleman & Daniel A. Haber: T790M-Mutation Epidermal growth factor receptor mutations in lung cancer Nature Reviews Cancer volume 7, pages 169–181 (2007)
- ↑ Pharmazeutische Zeitung Arzneistoffe Osimertinib abgerufen am 04.10.2018
- ↑ Neues Anwendungsgebiet (laut Zulassung vom 28. Juni 2024), G-BA, abgerufen am 06.02.2025
- ↑ Lin CY et al. Cardiac Events and Survival in Patients With EGFR-Mutant Non-Small Cell Lung Cancer Treated With Osimertinib. JAMA Netw Open. 2024
- ↑ 6,0 6,1 IQWiG-Berichte – Nr. 527 Osimertinib –Bewertung gemäß § 35a Abs. 1 Satz 10 SGB V abgerufen am 04.10.2018