Asciminib
Handelsname(n): Scemblix®
Synonym: ABL001
Englisch: asciminib
Definition
Asciminib ist ein antineoplastischer Arzneistoff aus der Gruppe der Tyrosinkinasehemmer, der zur Subgruppe der BCR-ABL-Inhibitoren bzw. der STAMP-Inhibitoren gehört. Er wird zur Behandlung der Philadelphia-Chromosom-positiven CML eingesetzt.
Hintergrund
Chemie
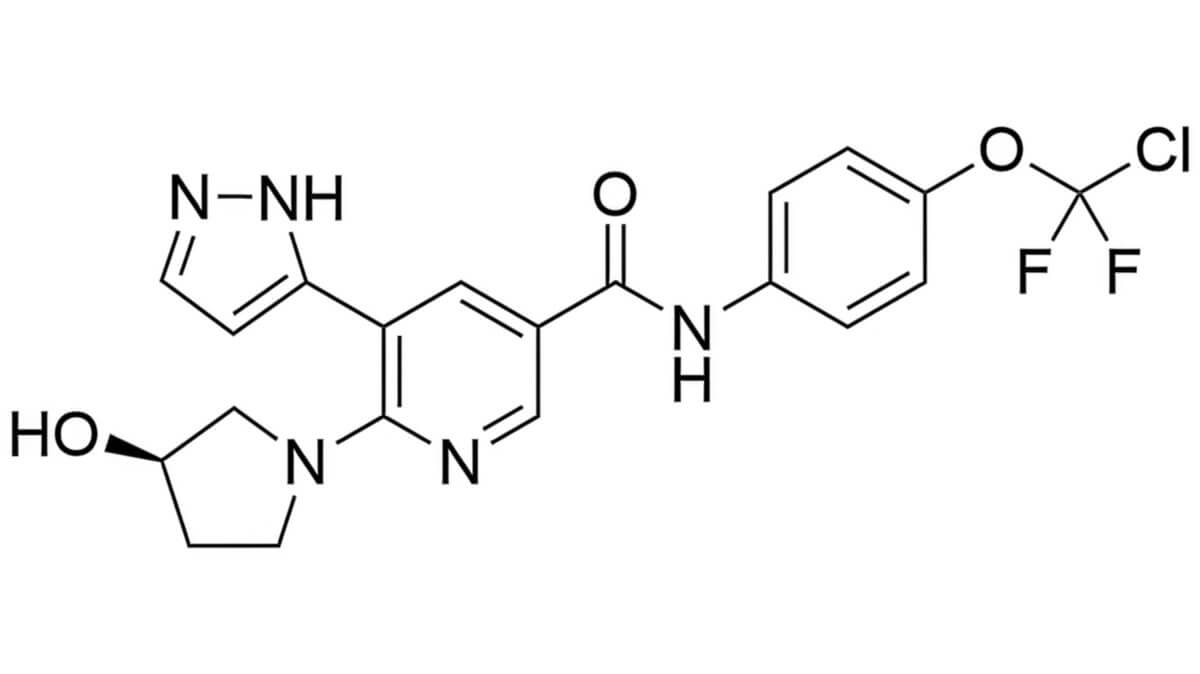
Wie andere Kinasehemmer ist Asciminib ein stickstoffreicher Arzneistoff mit einer 2-Pyrazol-Pyridin-Struktur. Die Verbindung ist eine Base. Die Summenformel von Asciminib ist C20H18ClF2N5O3. Das Molekulargewicht beträgt 449,8 g/mol.
Wirkmechanismus
Asciminib richtet sich gegen das Genprodukt des BCR-ABL-Fusionsgens auf dem Philadelphia-Chromosom. Dabei handelt es sich um eine konstitutiv aktivierte Tyrosinkinase, die zur unkontrollierten und massiven Proliferation der Tumorzellen führt. Asciminib belegt die Myristat-bindende Tasche von ABL und bewirkt dadurch eine allosterische Hemmung der Tyrosinkinase.[1] Sie führt zum Abbruch der von ihr ausgelösten Signalkaskade - dadurch kommt es zur Apoptose der Tumorzellen und zu einer Regression des Tumors.
Pharmakokinetik
Die Resorption von Asciminib erfolgt nach oraler Gabe innerhalb von 2-3 Stunden. Die Bioverfügbarkeit beträgt 73 %. Nahrungsaufnahme verringert die Resorption, deshalb das Medikament nüchtern eingenommen werden.
Das Verteilungsvolumen liegt bei 111 Litern, die Eliminationshalbwertszeit bei 5,2 Stunden. Die Verstoffwechselung erfolgt durch das Cytochrom-P450-System. Die Ausscheidung findet überwiegend über den Stuhl statt.[2]
Indikation
- erwachsene Patienten mit Philadelphia-Chromosom-positiver chronisch myeloischer Leukämie (CML) in der chronischen Phase, die zuvor schon mit zwei oder mehr Tyrosinkinasehemmern behandelt wurden.[2]
Darreichungsform
Asciminib ist als Filmtablette mit 20 bzw. 40 mg Wirkstoff erhältlich.
Dosierung
Die empfohlene Dosierung beträgt zweimal täglich 40 mg. Die Behandlung wird so lange fortgeführt, wie die Behandlung vertragen wird und ein klinischer Nutzen ersichtlich ist. Beim Auftreten von Nebenwirkungen kann die Dosis auf 20 mg zweimal täglich reduziert werden.[2]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
- Myelosuppression (Thrombozytopenie, Neutropenie, Anämie): Die Myelosuppression ist in der Regel reversibel, wenn der Arzneistoff reduziert bzw. abgesetzt wird. Zur Kontrolle sollte alle drei Monate ein Blutbild angefertigt werden.
- Pankreastoxizität: Pankreatitis, Erhöhung der Serumlipase und -amylase. Die Werte sollten monatlich kontrolliert werden; sollten diesbezüglich Symptome auftreten, ist die Dosis zu reduzieren.
- QT-Verlängerung
- Hypertonie
- Reaktivierung einer Hepatitis B
- erhöhtes Infektionsrisiko
- Dyslipidämie
- Kopfschmerzen, Schwindel
- Husten, Dyspnoe, Brustschmerz
- Übelkeit, Erbrechen, Durchfall
- erhöhte Leberenzyme und Bilirubin
- Fatigue, Pruritus
Wechselwirkungen
- Arzneimittel, die das Auftreten einer QT-Zeit-Verlängerung begünstigen können.
- CYP3A4- und CYP2C9-Substrate, v.a. solche mit geringer therapeutischer Breite, da deren Konzentration erhöht wird.
- CYP3A4-Induktoren können die Plasmaspiegel von Asciminib erniedrigen, was zu einer verminderten Wirksamkeit führen kann.[2]
Kontraindikationen
- Überempfindlichkeit gegen den Wirkstoff
Zulassung
Asciminib wurde im Jahr 2021 in den USA und 2022 in Europa zugelassen. Die Substanz wurde von Novartis entwickelt.
Quellen
- ↑ Laura N. Eadie et al.: The new allosteric inhibitor asciminib is susceptible to resistance mediated by ABCB1 and ABCG2 overexpression in vitro Oncotarget. 2018 Mar 2; 9(17): 13423–13437. Published online 2018 Feb 3 PMCID: PMC5862588 PMID: 29568367
- ↑ 2,0 2,1 2,2 2,3 Scemblix Filmtabletten: Zusammenfassung der Merkmale des Arzneimittels (Fachinfo)