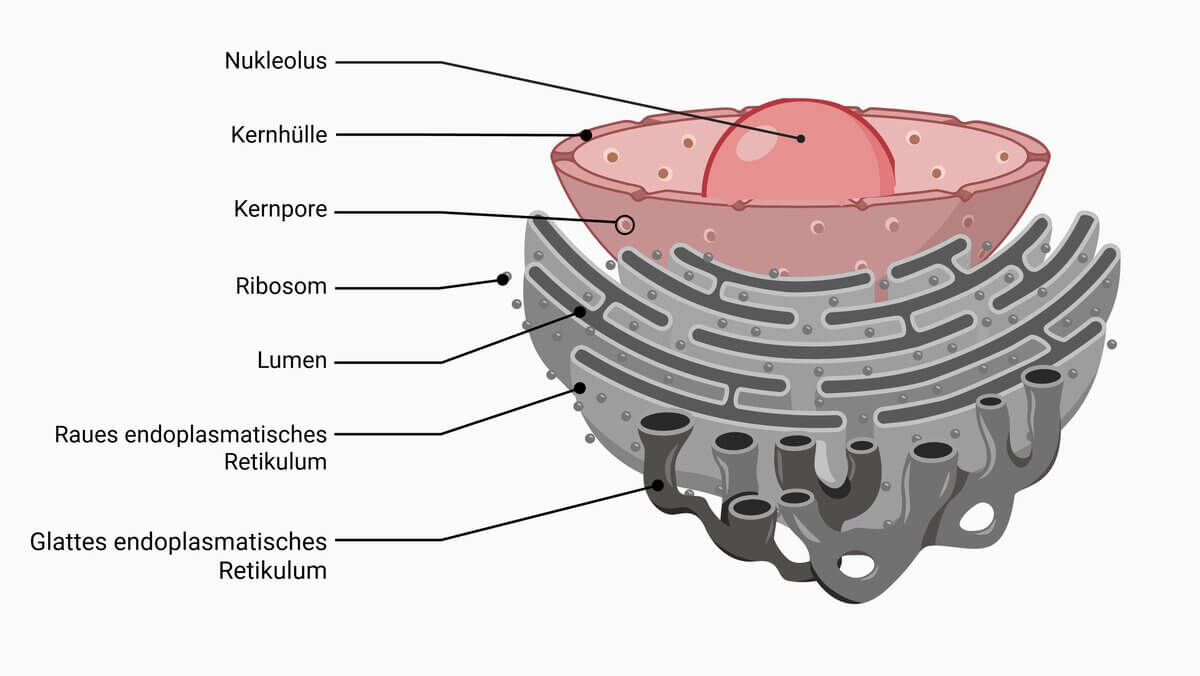
Raues endoplasmatisches Retikulum
Synonyme: granuliertes endoplasmatisches Retikulum, raues ER, RER
Englisch: rough endoplasmic reticulum
Definition
Als raues endoplasmatisches Retikulum, kurz RER, bezeichnet man den mit Ribosomen besetzten Anteil des endoplasmatischen Retikulums, der vermehrt an der Proteinbiosynthese und der posttranslationalen Modifikation neu gebildeter Proteine beteiligt ist.
Hintergrund
RER findet man in beinahe allen eukaryotischen Zellen, mit Ausnahme der ausdifferenzierten Erythrozyten. Es steht mit der Membran des Zellkerns in direkter Verbindung, so dass der perinukleäre Spalt nahtlos in das Lumen des rauen endoplasmatischen Retikulums übergeht. Dieser Bereich erscheint im elektronenmikroskopischen Bild als Gruppe rauer, granulierter Membranen.
Die Ribosomen des rauen ERs sind nicht dauerhaft mit der Membran assoziiert, sondern lagern sich jeweils nach Bedarf an.
Funktion
Hauptfunktionen des rauen ERs sind die Proteinbiosynthese und -faltung sowie die Membranproduktion. Über den sogenannten cotranslationalen Proteintransport am ER werden u.a. folgende Proteine einer Zelle gebildet:
- integrale Membranproteine und luminale Proteine von Organellen des Endomembransystems
- Proteine, die von der Zelle sezerniert werden. Ein großer Teil dieser Proteine wird nach der Synthese vom ER aus über vesikulären Transport weiter zu anderen Organellen verteilt.
- lysosomale Enzyme
Das Lumen des ERs enthält verschiedene Chaperone, welche die korrekte Faltung der neu synthetisierten Proteine gewährleisten. Hier werden Proteine außerdem durch N-Glykosylierung posttranslational modifiziert.
Biochemie
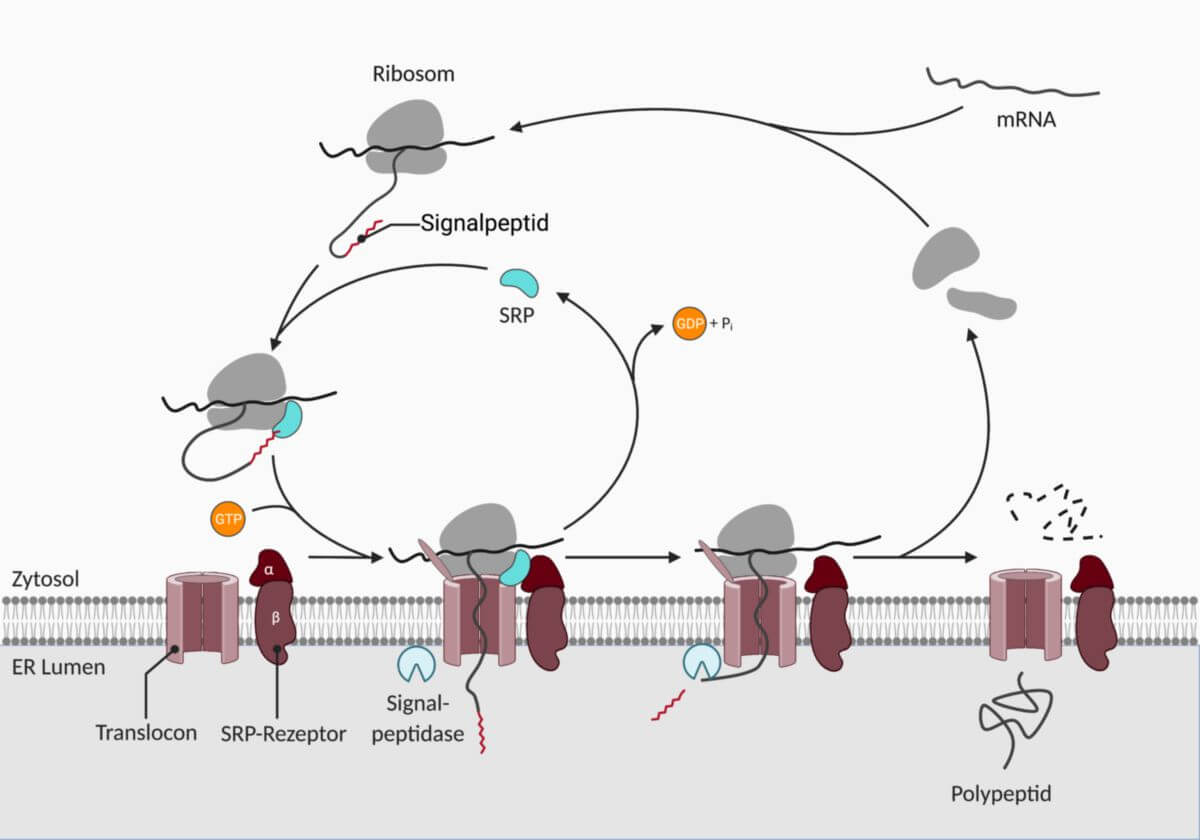
Die Translation von mRNAs beginnt zunächst im Zytosol. Proteine, die für die Sekretion bestimmt sind, enthalten im N-terminalen Bereich eine Signalsequenz. Sobald diese aus dem Kanal der großen ribosomalen Untereinheit herausragt, wird sie durch ein Signalerkennungspartikel (SRP) erkannt.
An der Membran des rauen ER befinden sich SRP-Rezeptoren und Translocons in direkter Nähe zueinander. Der SRP-Rezeptor interagiert mit dem SRP wodurch der Translationskomplex an die Membran des RERs verlagert wird. Beim Translocon handelt es sich um einen Proteinkomplex, der eine Pore in der Membran bildet und so den Membrantransport der neu synthetisierten Polypeptidkette in das Lumen des RER ermöglicht. Dort wird der Polypeptidstrang zurechtgeschnitten und gefaltet.
Anschließend können im Rahmen der posttranslationalen Modifikation Oligosaccharidreste auf den Amid-Stickstoff der Aminosäure Asparagin übertragen werden. Diese N-Glykosylierung wird durch ER-ständige Glykosyltransferasen katalysiert. Bei lysosomalen Enzymen wird beispielsweise Mannose-6-phosphat (M6P) angeheftet.
Die resultierenden Glykoproteine werden anschließend in COPII-Vesikel verpackt und an den Cis-Bereich des Golgi-Apparates gesendet, um weiter modifiziert ("Trimming") und sortiert zu werden. ER-residente Proteine werden vom cis-Bereich des Golgi-Apparats über COPI-Vesikel zurück zum rauen ER gesandt.