Signalerkennungspartikel
Synonym: SRP
Englisch: signal recognition particle
Definition
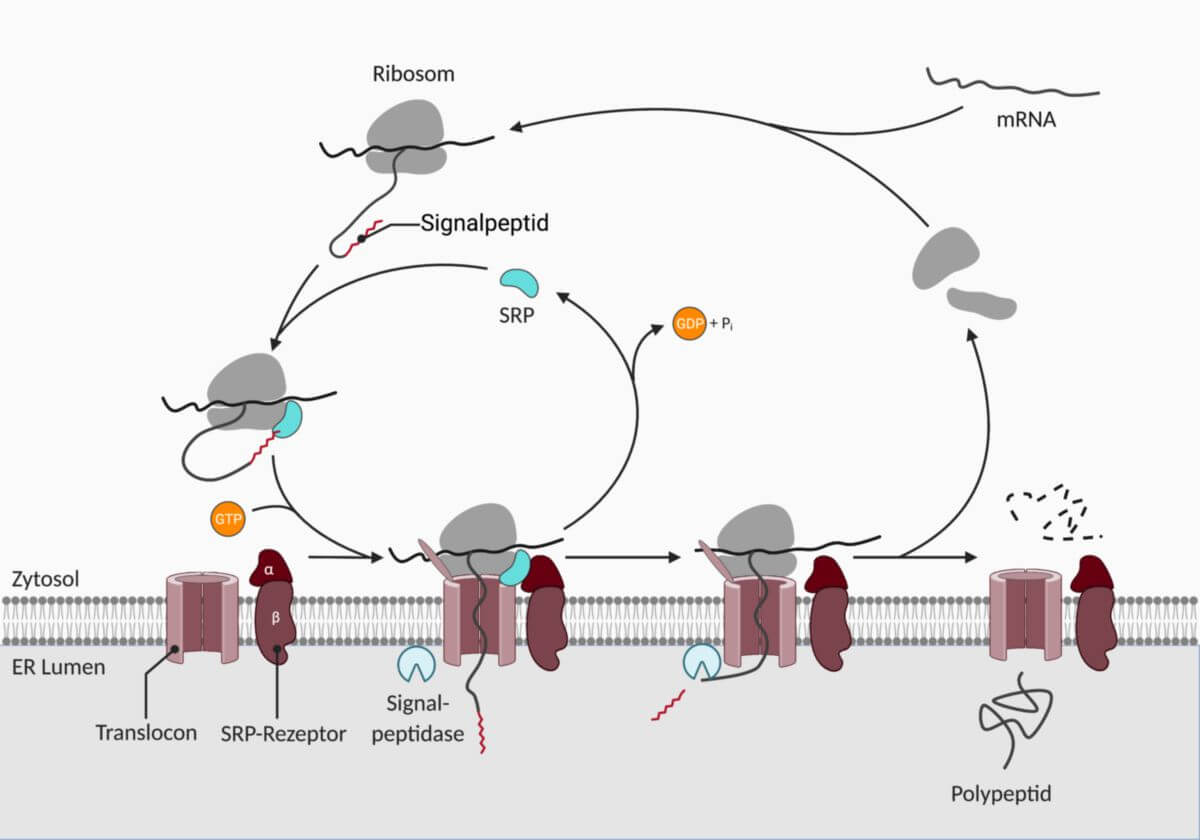
Das Signalerkennungspartikel, kurz SRP, ist ein Ribonukleoproteinkomplex, der das Signalpeptid von neu synthetisierten Proteinen erkennt. Es lotst den Komplex aus Ribosom und mRNA zum rauen endoplasmatischen Retikulum (RER), wo es an den SRP-Rezeptor bindet.
Hintergrund
Abhängig von ihrem Bestimmungsort werden Proteine entweder im Zytosol oder am RER synthetisiert. Proteine, die am RER gebildet werden, können dann über das Endomembransystem weiter verteilt und über Vesikel sezerniert werden. Sie enthalten zur Erkennung eine Signalsequenz, die auch als Signalpeptid bezeichnet wird. Diese wird durch das SRP erkannt, das anschließend den cotranslationalen Proteintransport vermittelt. Es sorgt zudem dafür, dass die weitere Translation des Proteins vorerst pausiert wird.
Biochemie
Aufbau
Das SRP besteht aus sechs verschiedenen Polypeptiden, die nach ihrem Molekulargewicht benannt sind: SRP9, SRP14, SRP19, SRP54, SRP68 und SRP72. Hinzu kommt ein RNA-Molekül, das als 7SL-RNA oder SRP-RNA bezeichnet wird. Der Ribonukleoproteinkomplex gliedert sich in zwei Domänen:
- Alu-Domäne: besteht aus einem SRP9/SRP14-Heterodimer und Anteilen der RNA. Diese Domäne bindet an das Ribosom und bewirkt dort ein Pausieren der Elongation.
- S-Domäne: besteht aus SRP19, SRP54 und SRP68/72. Dieser Teil des Komplexes spielt eine Rolle bei der Erkennung des Signalpeptids und der Interaktion mit dem SRP-Rezeptor.
Reaktionsenergie
Sowohl das SRP, als auch der SRP-Rezeptor benötigen Guanosintriphosphat (GTP) als Cofaktor. Die SRP54-Untereinheit fungiert als GTPase, die GTP zu GDP hydrolysiert. Diese Reaktion ist entscheidend für die Dissoziation vom SRP-Rezeptor.
Mechanismus
Das Signalpeptid befindet sich am N-Terminus des wachsenden Polypeptidstrangs. Sobald es vollständig aus dem Kanal der großen ribosomalen Untereinheit herausragt, wird es vom SRP erkannt und gebunden. Die beiden Domänen des SRP sind über eine flexible Gelenkregion ("hinge") verbunden und interagieren sowohl mit dem Signalpeptid, als auch mit Bestandteilen des Ribosoms und der mRNA. Das SRP unterbindet zunächst die weitere Translation und führt dann den gesamten Translationskomplex zum RER. Dort bindet es an den SRP-Rezeptor, wodurch sich das assoziierte Translocon, ein Proteinkanal in der RER-Membran, öffnet. Es kommt zur Translokation der Polypeptidkette durch den Kanal und unter GTP-Hydrolyse zur Dissoziation des SRP. Die Elongation der Polypeptidkette wird danach ins ER-Lumen fortgesetzt.
Klinik
Autoantikörper gegen das Signalerkennungspartikel werden als Anti-SRP bezeichnet. Sie treten bei schweren Verlaufsformen einer Polymyositis (nekrotisierende Myositis) auf.
Quellen
- Endspurt Vorklinik Biochemie 3, 4. Auflage, 2017
- Soni et al. Structural analysis of the SRP Alu domain from Plasmodium falciparum reveals a non-canonical open conformation Commun Biol 2021
- Keenan et al. The signal recognition particle Annu Rev Biochem 2001