SRP-Rezeptor
Synonym: Docking-Protein
Englisch: signal recognition particle receptor, SRP receptor, docking protein
Definition
Der SRP-Rezeptor ist ein Transmembranprotein, das bei Eukaryoten während der Translation für die Anlagerung des Ribosoms an die Membran des rauen endoplasmatischen Retikulums (RER) sorgt. Bei Prokaryoten vermittelt es stattdessen die Anlagerung an die Plasmamembran. Der Rezeptor erkennt ein Signalerkennungspartikel (SRP), das an bestimmte Signalpeptide von neu synthetisierten Polypeptidketten bindet.
Hintergrund
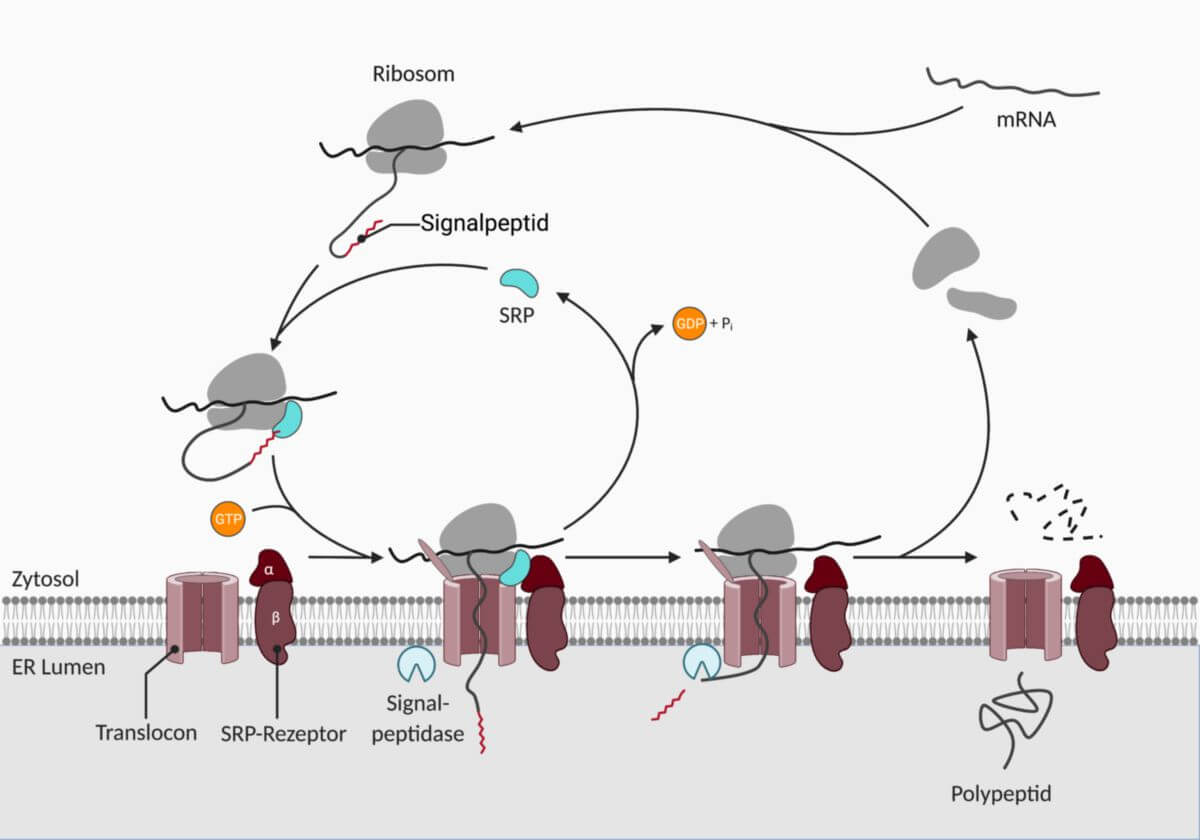
Abhängig von ihrem Bestimmungsort werden Proteine entweder im Zytosol oder am RER synthetisiert. Proteine, die am RER gebildet werden, können über das Endomembransystem weiter verteilt und über Vesikel sezerniert werden. Sie enthalten zur Erkennung eine Signalsequenz, die auch als Signalpeptid bezeichnet wird. Diese wird durch das SRP erkannt, das anschließend durch Bindung an den SRP-Rezeptor den cotranslationalen Proteintransport vermittelt.
Biochemie
Aufbau
Der SRP-Rezeptor ist bei Eukaryoten ein Heterodimer, das aus einer α-Untereinheit von 70 kDa (SRPRA) und einer β-Untereinheit von 25 kDa (SRPRB) aufgebaut ist. Letztere ist ein Transmembranprotein, das die α-Untereinheit in der Membran des rauen endoplasmatischen Retikulums (raues ER, RER) verankert.
Reaktionsenergie
Sowohl SRP, als auch der SRP-Rezeptor benötigen Guanosintriphosphat (GTP) als Cofaktor. Beide Untereinheiten des SRP-Rezeptors besitzen GTPase-Aktivität. Die GTP-Hydrolyse ist entscheidend für die Dissoziation von SRP und SRP-Rezeptor.
Mechanismus
Polypeptide, die für die Sekretion bestimmt sind, enthalten am N-terminalen Ende eine Signalsequenz, die durch das SRP erkannt und gebunden wird. Die Bindung sorgt dafür, dass die Translation des Polypeptids am Ribosom vorübergehend unterbrochen wird. Der Komplex aus SRP, Polypeptid und Ribosom bindet daraufhin an den SRP-Rezeptor auf der Membran des rauen ER. Dabei interagiert die α-Untereinheit des SRP-Rezeptors mit der S-Domäne des SRPs. Die interagierenden Bereiche werden auch als NG-Domäne bezeichnet.
Unter Hydrolyse von GTP zu GDP wird das SRP vom Komplex abgespalten. Dabei lagert sich das Ribosom an einen benachbarten Proteinkanal, das Translocon, an. Das Ribosom setzt hier die Translation durch das geöffnete Translocon weiter in das Lumen des RER fort. Im RER wird die neu entstandene Polypeptidkette eingekürzt und gefaltet.