N-Glykosylierung
Englisch: N-linked glycosylation
Definition
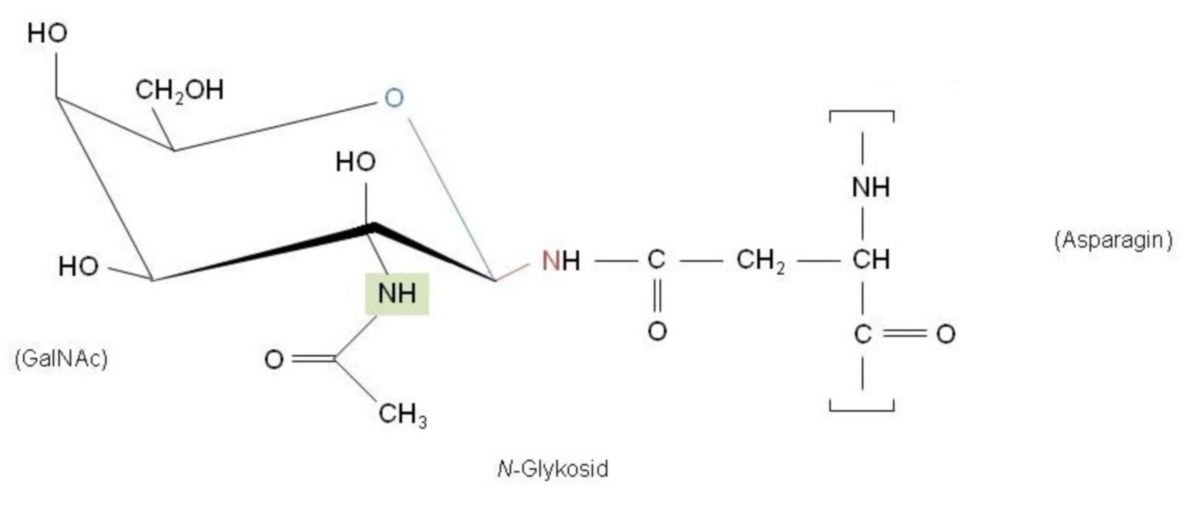
Als N-Glykosylierung wird das Anbinden eines Zuckerrestes an einen Asparaginrest im Zuge einer Glykosylierung bezeichnet.
Hintergrund
Eine Glykosylierung von Proteinen erfolgt cotranslational oder posttranslational. Die Zuckerreste können einerseits an einen Asparaginrest (N-glykosidisch) oder an einen Serin- oder Threoninrest (O-glykosidisch) gebunden werden.
Chemie
Biochemie
Der Großteil der Zuckerketten, die N-glykosidisch über Asparagin an ein Protein gebunden werden, zählen zum sog. komplexen Typ. Die darin vorkommenden Zuckerreste sind Mannose, Glucose, Galaktose, Fucose, N-Acetylglucosamin und N-Acetylneuraminsäure. Eine derartige N-Glykosylierung von Proteinen erfolgt cotranslational im ER.
Erst wird das Grundgerüst des Oligosaccharids, die Kernregion (Core Glycosid), synthetisiert. Dabei wird das Core Glycosid an der Membran des ER zusammengebaut, wobei als Träger für das entstehende Oligosaccharid das Isoprenderivat Dolicholphosphat (Dol-P) dient. Das Dolicholphoshat steckt mit seinem Isopren-Anteil im ER, während der Phosphatrest im Cytosol hängt. An diesen Rest werden zwei N-Acetylglucosamine und fünf Mannosereste angeknüpft. Anschließend wird die Verbindung transloziert. Die Saccharide hängen jetzt im ER, wo noch weitere Zucker angeknüpft werden. Schließlich wird der Komplex vom Dolicholphosphat abgespalten und auf die Asparaginseitenkette eines Polypeptids übertragen. Dieser Reaktionsablauf findet im ER statt. Der letzte Schritt zum fertigen Protein ist das sogenannte Trimming: Ein Teil der Zuckerreste wird im Golgi-Apparat wieder abgespalten und durch andere, für das Glykoprotein typische Saccharide (z. B. Galactose, Fructose, Sialinsäure) ersetzt.
Literatur
- "Duale Reihe Biochemie" - Joachim Rassow et. al., Thieme-Verlag, 3. Auflage