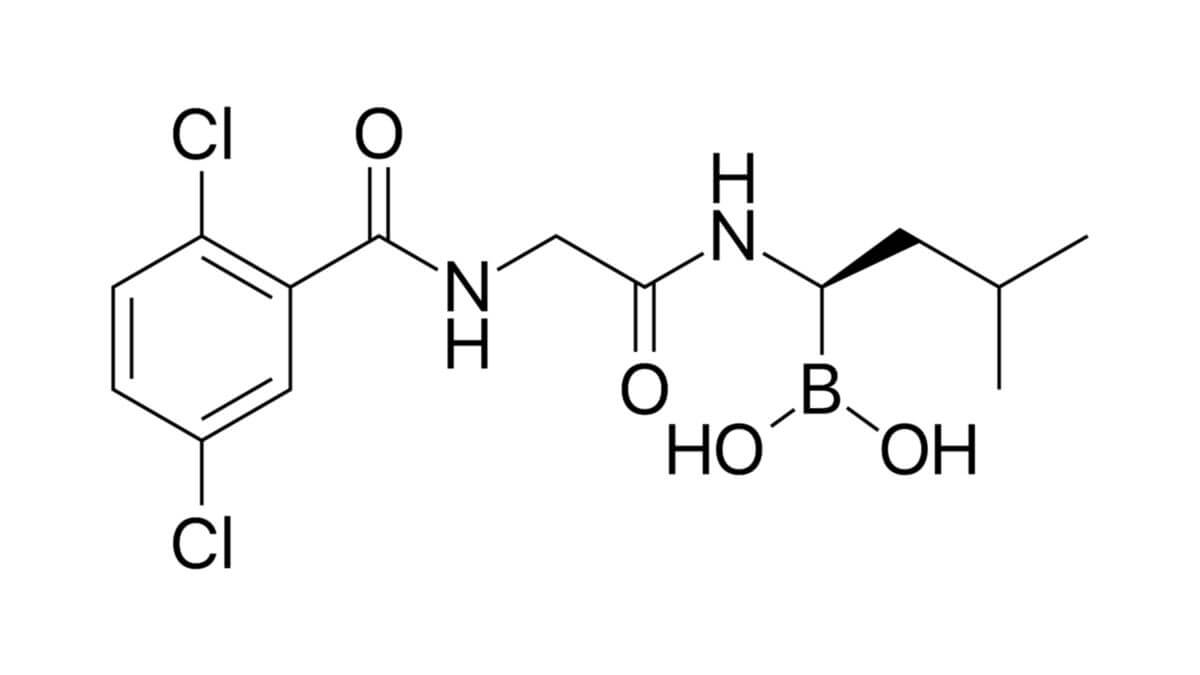
Ixazomib
Handelsname: Ninlaro®
Definition
Ixazomib ist ein selektiver Proteasom-Inhibitor, der zur Behandlung des multiplen Myeloms eingesetzt wird.[1]
Chemie
Die Summenformel von Ixazomib lautet C14H19BCl2N2O4. Das Molekulargewicht beträgt 361,03 g/mol.
Wirkmechanismus
Ixazomib bindet selektiv und reversibel an die Chymotrypsin-ähnliche β-5-Untereinheit des 20S-Proteasoms. Dadurch verhindert der Arzneistoff, dass dieser Komplex fehlerhafte Proteine abbaut und es kommt zur Apoptose von Tumorzellen. Ixazomib ist der erste oral verfügbare Proteasom-Inhibitor und wird nur in Kombination mit Lenalidomid und Dexamethason angewendet. Die zytotoxischen Wirkungen von Ixazomib und Lenalidomid auf Myelomzellen scheinen sich gegenseitig zu verstärken.
Ixazomib wird aus dem Prodrug Ixazomibcitrat unter physiologischen Bedingungen schnell in seine biologisch aktive Form hydrolysiert.[1]
Pharmakokinetik
Maximale Plasmakonzentrationen werden etwa eine Stunde nach der oralen Einnahme von Ixazomib erreicht. Die absolute Bioverfügbarkeit beträgt 58 %. Ixazomib liegt zu 99 % an Plasmaproteine gebunden vor. Die Metabolisierung erfolgt hauptsächlich über das Cytochrom-P450-System. Die Eliminationshalbwertszeit beträgt laut Fachinformation 9,5 Tage.[1]
Indikation
- Kombinationstherapie mit Lenalidomid und Dexamethason zur Therapie des multiplen Myeloms bei erwachsenen Patienten, die mindestens eine vorausgegangene Therapie erhalten haben[1]
Darreichungsform
Ixazomib ist in Form von Hartkapseln in verschiedenen Dosierungen erhältlich.[1]
Dosierung
Die empfohlene Initialdosis von Ixazomib beträgt einmal wöchentlich 4 mg. Die Therapie erfolgt nach einem 28-Tage-Schema. An den Tagen 1, 8 und 15 wird jeweils eine Kapsel Ixazomib verabreicht. [1]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Folgende Nebenwirkungen treten unter der Einnahme von Ixazomib sehr häufig (≥ 1/10) oder häufig (≥ 1/100, < 1/10) auf:[1]
- Infektionen: Infektionen der oberen Atemwege, Herpes zoster
- Blut- und Lymphsystem: Thrombozytopenie, Neutropenie
- Nervensystem: periphere Neuropathien
- Gastrointestinaltrakt: Diarrhö, Nausea, Erbrechen, Obstipation
- Haut: Exanthem
- Skelettmuskulatur: Rückenschmerzen
- Allgemein: Peripheres Ödem
Wechselwirkungen
Da Ixazomib hauptsächlich über das Cytochrom-P450-System metabolisiert wird, ergeben sich daraus entsprechende Interaktionen. Die gleichzeitige Anwendung von CYP-Induktoren wird wegen einer Wirkabschwächung des Arzneistoffs nicht empfohlen.[1]
Kontraindikationen
- Überempfindlichkeit gegenüber dem Wirkstoff
- Schwangerschaft und Stillzeit[1]
Zulassung
Ixazomib ist in der EU seit Ende 2016 als Orphan Drug zugelassen und wird von Takeda vermarktet.[1]
Nutzenbewertung
Der Zusatznutzen einer Therapie mit Ixazomib wird vom G-BA auf der Basis der vom IQWiG ausgewerteten Studienergebnisse wie folgt eingeordnet:[2][3]
- Zusatznutzen eines Orphan Drugs gilt durch die Zulassung als belegt
Kosten
Die Jahrestherapiekosten von Ixazomib liegen pro Patient bei rund 120 000 €.[2]