Rab: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
K (dc name tag added) |
||
| (14 dazwischenliegende Versionen von einem anderen Benutzer werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
''Synonym: Rab-Protein, Rab-GTPase''<br> | ''Synonym: Rab-Protein, Rab-GTPase''<br> | ||
'''''Englisch:''' rab'' | '''''Englisch:''' <name lang="en">rab</name>'' | ||
==Definition== | ==Definition== | ||
'''Rab-Proteine''', kurz '''Rabs''', sind [[monomer]]e [[G-Protein]]e, die | '''Rab-Proteine''', kurz '''Rabs''', sind [[monomer]]e [[G-Protein]]e, die zur [[Ras-Superfamilie]] zählen. Im menschlichen [[Genom]] sind 76 Rab-Proteine [[kodiert]], womit sie die größte Unterfamilie unter den kleinen [[GTPase]]n bilden. Sie sind an der Regulation des [[vesikulärer Transport|vesikulären Transports]] im [[Endomembransystem]] beteiligt. | ||
==Nomenklatur== | |||
Rab ist ein [[Akronym]] und steht für "[[Ras]]-like proteins in brain" (engl. für Ras-ähnliches Protein im Gehirn). | |||
==Biochemie== | ==Biochemie== | ||
Rab-Proteine haben ein [[Molekulargewicht]] zwischen 20 und 40 [[Dalton|kDa]]. Am [[C-Terminus]] findet sich eine [[Cystein]]-reiche Sequenz, über welche die Proteine [[posttranslational]] modifiziert werden. Über eine [[Thioetherbindung]] werden ein oder zwei [[Geranylgeranylrest]]e gebunden, die auch als [[Lipidanker]] bezeichnet werden. | Rab-Proteine haben ein [[Molekulargewicht]] zwischen 20 und 40 [[Dalton|kDa]]. Am [[C-Terminus]] findet sich eine [[Cystein]]-reiche Sequenz, über welche die Proteine [[posttranslational]] modifiziert werden. Über eine [[Thioetherbindung]] werden ein oder zwei [[Geranylgeranylrest]]e gebunden, die auch als [[Lipidanker]] bezeichnet werden. Rab-Proteine können die [[Nukleotid]]e [[Guanosindiphosphat]] (GDP) und [[Guanosintriphosphat]] (GTP) binden. | ||
=== | ===GTP/GDP-Zyklus=== | ||
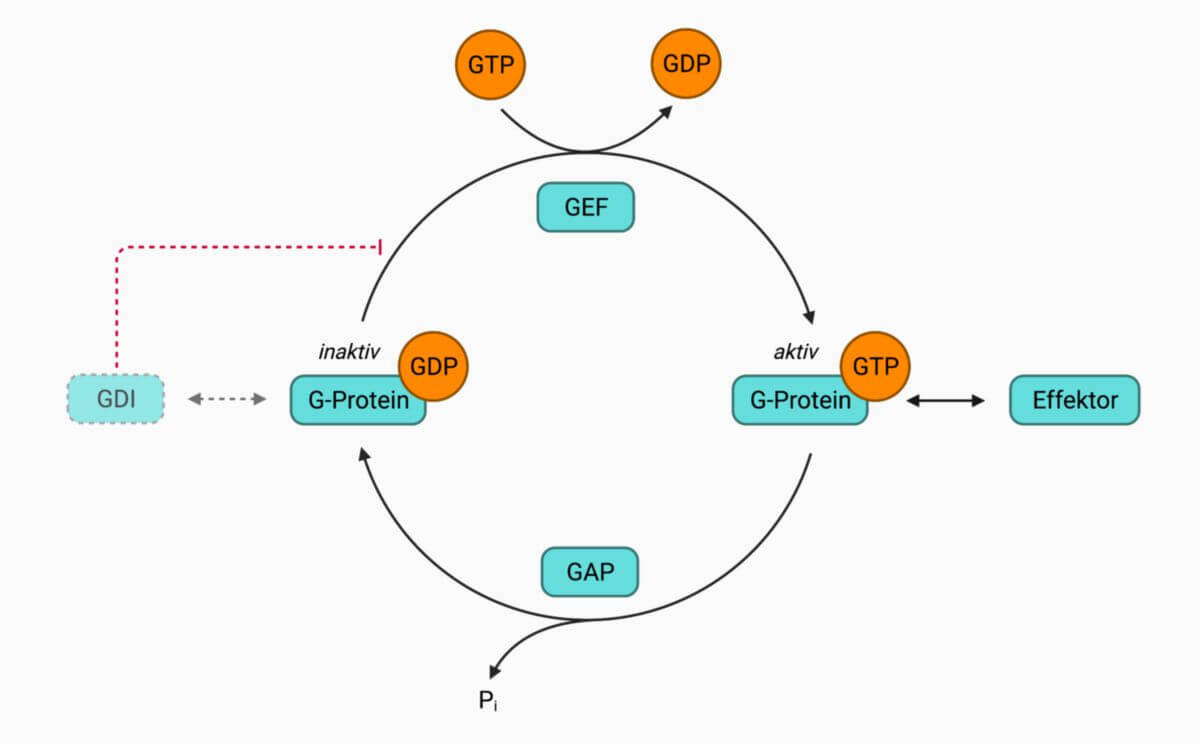
Rab-Proteine liegen in zwei Formen vor: Rab-GTP ist [[peripher]] über den Lipidanker an zelluläre Membranen gebunden und aktiv, Rab-GDP liegt frei im [[Zytosol]] vor und ist inaktiv. Der Wechsel zwischen diesen beiden Lokalisationen wird durch verschiedene Proteine gesteuert. Im Zytosol bindet ein [[ | Rab-Proteine liegen in zwei Formen vor: Rab-GTP ist [[peripher]] über den Lipidanker an zelluläre Membranen gebunden und aktiv, Rab-GDP liegt frei im [[Zytosol]] vor und ist inaktiv. Der Wechsel zwischen diesen beiden Lokalisationen wird durch verschiedene Proteine gesteuert. Im Zytosol bindet ein [[Guaninnukleotid-Dissoziationsinhibitor]] (GDI) Rab-GDP und stabilisiert die inaktive Form. Ein [[Guaninnukleotid-Austauschfaktor]] (GEF) tauscht GDP gegen GTP aus und aktiviert dadurch das Rab-Protein. Rabs sind sogenannte schwache GTPasen, was bedeute, dass ihre [[intrinsisch]]e [[Hydrolyse]]aktivität gering ist. [[GTPase-aktivierendes Protein|GTPase-aktivierende Proteine]] ([[GAP]]) erhöhen die [[enzymatisch]]e Aktivität, sodass GTP unter Freisetzung von [[Phosphat]] zu [[GDP]] hydrolysiert wird. Rab-GDP löst sich von der Membran und wird im Zytosol wieder von GDI gebunden. | ||
<dcembed><dcembedurl src="https://www.doccheck.com/de/detail/photos/42054-gtp-gdp-zyklus-der-kleinen-g-proteine" height="360"></dcembedurl></dcembed> | |||
==Funktion== | ==Funktion== | ||
| Zeile 15: | Zeile 20: | ||
===Bildung von Vesikeln=== | ===Bildung von Vesikeln=== | ||
An Membranen von verschiedenen [[Organell]]en werden durch Knospung und Abschnürung Vesikel gebildet, die zu anderen Organellen transportiert werden. Rab-GTP bindet an diesen Membranen sogenannte [[ | An Membranen von verschiedenen [[Organell]]en werden durch Knospung und Abschnürung Vesikel gebildet, die zu anderen Organellen transportiert werden. Rab-GTP bindet an diesen Membranen sogenannte [[Mantelprotein]]e, die für Bildung der Vesikel nötig sind. | ||
===Transport von Vesikeln=== | ===Transport von Vesikeln=== | ||
Rab-GTP, das an Vesikel gebunden ist, kann gleichzeitig [[ | Rab-GTP, das an Vesikel gebunden ist, kann gleichzeitig [[Adapterproteinkomplex]]e binden, die mit [[Motorprotein]]en wie [[Myosin]] interagieren. Dadurch werden die Vesikel entlang des [[Zytoskelett]]s transportiert. | ||
===Fusion von Vesikeln=== | ===Fusion von Vesikeln=== | ||
Weitere Effektoren, die Rab-GTP bindet, sind Tethering-Komplexe und [[SNARE]]-Proteine, die für die Fusion zwischen Vesikel und Zielmembran verantwortlich sind. | Weitere Effektoren, die Rab-GTP bindet, sind Tethering-Komplexe und [[SNARE]]-Proteine, die für die Fusion zwischen Vesikel und Zielmembran verantwortlich sind. | ||
== | ==Klinik== | ||
Die Regulation des vesikulären Transports in Zellen ist ein komplexer Prozess, der noch nicht vollständig verstanden ist. Fehler in diesem System sind mit verschiedenen Krankheiten verbunden. Einige | Die Regulation des vesikulären Transports in Zellen ist ein komplexer Prozess, der noch nicht vollständig verstanden ist. Fehler in diesem System sind mit verschiedenen Krankheiten verbunden. | ||
Einige [[Mutation]]en, die Rab-Proteine betreffen, sind als Ursache für bestimmte Krankheitsbilder identifiziert worden. So sind [[Missense-Mutation]]en in dem [[Gen]], das für [[RAB7]] kodiert, für die [[hereditäre motorisch-sensible Neuropathie Typ II]] verantwortlich. Missense-Mutationen in dem Gen, das für [[RAB39B]] kodiert, sind an der Entwicklung der [[X-chromosomaler Erbgang|X-chromosomal vererbt]]en [[Intelligenzminderung]] beteiligt. | |||
[[Fachgebiet:Biochemie]] | [[Fachgebiet:Biochemie]] | ||
[[Tag:Protein]] | [[Tag:Protein]] | ||
Aktuelle Version vom 21. März 2024, 10:00 Uhr
Synonym: Rab-Protein, Rab-GTPase
Englisch: rab
Definition
Rab-Proteine, kurz Rabs, sind monomere G-Proteine, die zur Ras-Superfamilie zählen. Im menschlichen Genom sind 76 Rab-Proteine kodiert, womit sie die größte Unterfamilie unter den kleinen GTPasen bilden. Sie sind an der Regulation des vesikulären Transports im Endomembransystem beteiligt.
Nomenklatur
Biochemie
Rab-Proteine haben ein Molekulargewicht zwischen 20 und 40 kDa. Am C-Terminus findet sich eine Cystein-reiche Sequenz, über welche die Proteine posttranslational modifiziert werden. Über eine Thioetherbindung werden ein oder zwei Geranylgeranylreste gebunden, die auch als Lipidanker bezeichnet werden. Rab-Proteine können die Nukleotide Guanosindiphosphat (GDP) und Guanosintriphosphat (GTP) binden.
GTP/GDP-Zyklus
Rab-Proteine liegen in zwei Formen vor: Rab-GTP ist peripher über den Lipidanker an zelluläre Membranen gebunden und aktiv, Rab-GDP liegt frei im Zytosol vor und ist inaktiv. Der Wechsel zwischen diesen beiden Lokalisationen wird durch verschiedene Proteine gesteuert. Im Zytosol bindet ein Guaninnukleotid-Dissoziationsinhibitor (GDI) Rab-GDP und stabilisiert die inaktive Form. Ein Guaninnukleotid-Austauschfaktor (GEF) tauscht GDP gegen GTP aus und aktiviert dadurch das Rab-Protein. Rabs sind sogenannte schwache GTPasen, was bedeute, dass ihre intrinsische Hydrolyseaktivität gering ist. GTPase-aktivierende Proteine (GAP) erhöhen die enzymatische Aktivität, sodass GTP unter Freisetzung von Phosphat zu GDP hydrolysiert wird. Rab-GDP löst sich von der Membran und wird im Zytosol wieder von GDI gebunden.
Funktion
Das membrangebundene Rab-GTP bindet Effektorproteine und reguliert damit verschiedene Prozesse im vesikulären Transport.
Bildung von Vesikeln
An Membranen von verschiedenen Organellen werden durch Knospung und Abschnürung Vesikel gebildet, die zu anderen Organellen transportiert werden. Rab-GTP bindet an diesen Membranen sogenannte Mantelproteine, die für Bildung der Vesikel nötig sind.
Transport von Vesikeln
Rab-GTP, das an Vesikel gebunden ist, kann gleichzeitig Adapterproteinkomplexe binden, die mit Motorproteinen wie Myosin interagieren. Dadurch werden die Vesikel entlang des Zytoskeletts transportiert.
Fusion von Vesikeln
Weitere Effektoren, die Rab-GTP bindet, sind Tethering-Komplexe und SNARE-Proteine, die für die Fusion zwischen Vesikel und Zielmembran verantwortlich sind.
Klinik
Die Regulation des vesikulären Transports in Zellen ist ein komplexer Prozess, der noch nicht vollständig verstanden ist. Fehler in diesem System sind mit verschiedenen Krankheiten verbunden.
Einige Mutationen, die Rab-Proteine betreffen, sind als Ursache für bestimmte Krankheitsbilder identifiziert worden. So sind Missense-Mutationen in dem Gen, das für RAB7 kodiert, für die hereditäre motorisch-sensible Neuropathie Typ II verantwortlich. Missense-Mutationen in dem Gen, das für RAB39B kodiert, sind an der Entwicklung der X-chromosomal vererbten Intelligenzminderung beteiligt.