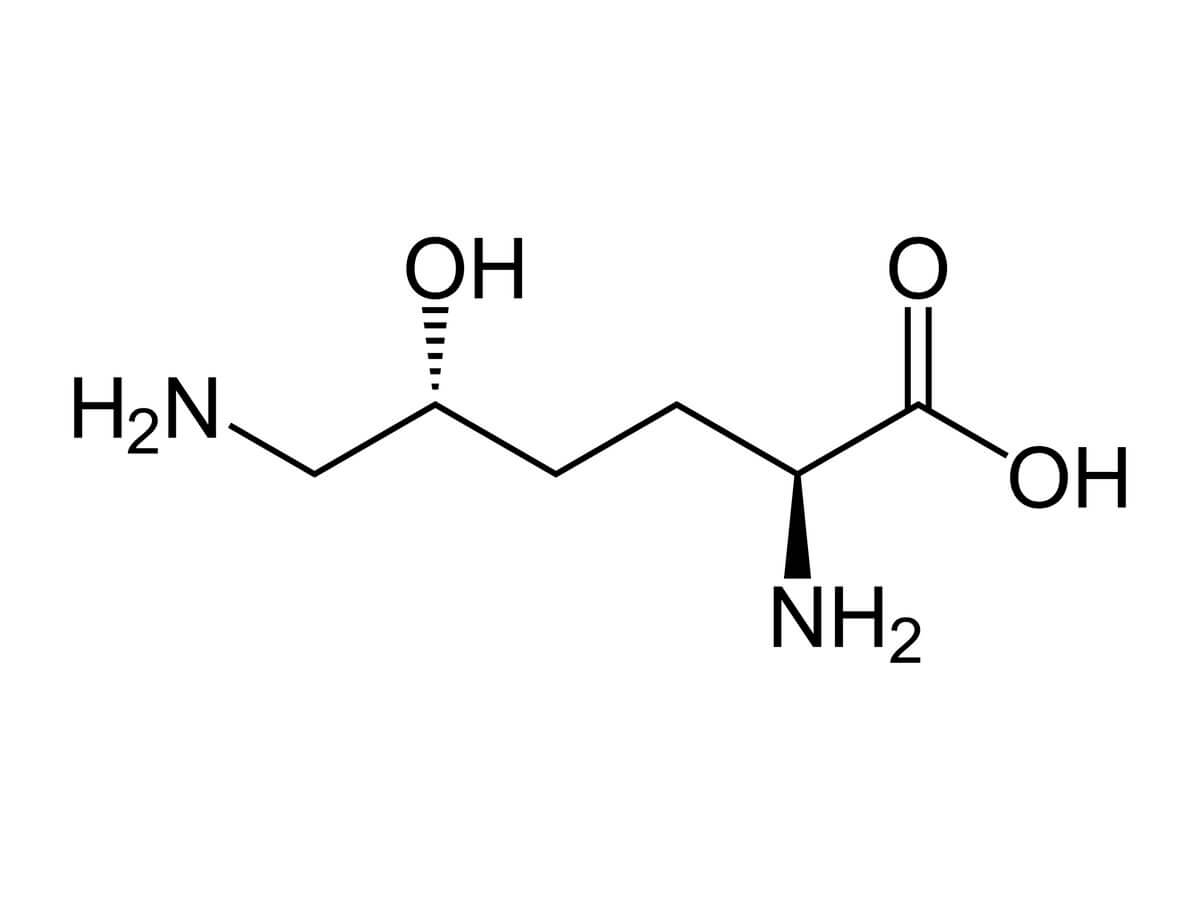
Hydroxylysin
Synonym: 5-Hydroxylysin
Definition
Hydroxylysin ist eine im menschlichen Organismus vorkommende basische Aminosäure. Den Aminosäurerest in Peptiden bezeichnet man als Hydroxylysylrest.
Chemie
Die chemische Summenformel von Hydroxylysin lautet:
- C6H14N2O3
Bei Zimmertemperatur liegt die Säure als Feststoff vor. Der Schmelzpunkt liegt bei etwa 227 – 230 °C. Die molare Masse beträgt 162,19 g/mol. Es handelt sich um eine farblose, kristalline, hydrophile Substanz. Bei physiologischem pH-Wert liegt Hydroylysin als Zwitterion vor. Durch die Hydroxylgruppe ist die Aminosäure hydrophiler als Lysin selbst und bildet somit einen wichtigen Vernetzungspunkt in der Kollagenstruktur.
Biochemie
Hydroxylysin besitzt eine Besonderheit bezüglich ihrer Beteiligung am Aufbau von Polypeptiden: Ein Einbau in Proteinmoleküle während der Translation findet bei Hydroxylysin nicht statt. Vielmehr wird zunächst Lysin in die Polypeptidkette eingefügt, ehe diese Aminosäure im Rahmen einer enzymgesteuerten posttranslationalen Modifikation hydroxyliert und oxidiert wird. Trotz dieser Besonderheit zählt Letztere zu den proteinogenen Aminosäuren.
siehe auch: Lysylhydroxylase und Lysyloxidase
Vorkommen
Die proteinogene Aminosäure ist Bestandteil einiger Glykoproteine. Des Weiteren ist sie in allen Arten Kollagen enthalten, die in menschlichen und tierischen Organismen zu finden sind. Auch in einigen Bakterienstämmen konnte Hydroxylysin identifiziert werden. Im Kollagen dient es der Quervernetzung einzelner Filamente und wirkt stabilisierend, indem es u.a. Wasserstoffbrückenbindungen zwischen Kollagenmolekülen ausbildet.
Labormedizin
Der Hydroxylysinspiegel kann sowohl im Blutserum als auch im Urin bestimmt werden.
Referenzwerte im Serum
- Neugeborene und Säuglinge bis 1 Jahr: bis 200 µmol/l
- Kinder 2-14 Jahre: bis 100 µmol/l
- Erwachsene: bis 50 µmol/l
Referenzwerte im Urin
- Neugeborene und Säuglinge bis 1 Jahr: bis 200 µmol/g Kreatinin
- Kinder 2-14 Jahre: bis 100 µmol/g Kreatinin
- Erwachsene: bis 50 µmol/g Kreatinin
Hinweis: Referenzwerte sind häufig vom Messverfahren abhängig und können von den o.a. Werten abweichen. Ausschlaggebend sind die Referenzwerte, die vom Labor angegeben werden, das die Untersuchung durchführt.
Klinik
Liegt ein Mangel an Hydroxylysin vor, sind verschiedene Formen von Bindegewebsschwäche die Folge. Ursache kann u.a. eine Synthesestörung (z.B. bei Vitamin-C-Mangel) oder ein Enzymdefekt der Lysylhydroxylase (Ehlers-Danlos-Syndrom Typ VI) sein. Die Stabilität des Kollagens lässt nach, da die Quervernetzung nicht mehr effektiv erfolgen kann. Liegt nur extrem wenig Hydroxylysin vor oder fehlt dieses völlig, ist das nicht mit dem Leben vereinbar. Hydroxylysin wird beim physiologischen Kollagenabbau im Knochen freigesetzt und über die Nieren ausgeschieden. Ein krankhafter Metabolismus von Kollagen kann so über einen erhöhten Spiegel der Aminosäure im Urin nachgewiesen werden.
Selten kann es genetisch bedingt zu einem mangelhaften Abbau von Hydroxylysin kommen. Diese Erkrankung wird als Hydroxylysinämie bezeichnet.